题目内容
下列关于Na2O2的叙述正确的是( )
| A、Na2O2中阴阳离子的个数比为1:1 |
| B、Na2O2分别与H2O和CO2反应产生等质量的O2时,转移电子的物质的量相同 |
| C、Na2O2可与H2O反应生成碱,所以Na2O2为碱性氧化物 |
| D、Na2O2的漂白原理与SO2相同 |
考点:钠的重要化合物
专题:
分析:A.Na2O2晶体中阳离子为Na+、阴离子为O22-;
B.Na2O2可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,由得失电子守恒分析;
C.Na2O2能和盐酸反应生成氯化钠和水和氧气;
D.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同.
B.Na2O2可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,由得失电子守恒分析;
C.Na2O2能和盐酸反应生成氯化钠和水和氧气;
D.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同.
解答:
解:A.Na2O2晶体中阳离子为Na+、阴离子为O22-,所以Na2O2晶体中阴阳离子个数之比为1:2,故A错误;
B.Na2O2可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,由得失电子守恒知两者转移电子的物质的量相同,故B正确;
C.Na2O2能和盐酸反应生成氯化钠和水和氧气,为过氧化物,不是碱性氧化物,故C错误;
D.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同,故D错误;
故选B.
B.Na2O2可与水及CO2反应,反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,由得失电子守恒知两者转移电子的物质的量相同,故B正确;
C.Na2O2能和盐酸反应生成氯化钠和水和氧气,为过氧化物,不是碱性氧化物,故C错误;
D.Na2O2因具有强氧化性而有漂白性,SO2易与有色物质化合生成无色不稳定的物质,故原理不同,故D错误;
故选B.
点评:本题主要考查了Na2O2的组成与结构、化学性质等,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
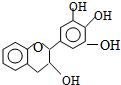 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )| A、分子中所有的原子共面 |
| B、1mol EGC能与4mol NaOH反应 |
| C、可以发生氧化反应、取代反应、加成反应、消去反应 |
| D、能与FeCl3溶液发生显色反应 |
下面不是化学方法处理污水的是( )
| A、过滤法 | B、混凝法 |
| C、中和法 | D、沉淀法 |
下列反应的离子反应方程式书写正确的是( )
| A、少量金属钠加到冷水中:Na+H2O=Na++OH-+H2↑ |
| B、铁与稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑ |
| C、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1 ②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,下列结论正确的是( )
| A、反应①为放热反应 |
| B、碳的燃烧热大于110.5 kJ?mol-1 |
| C、浓硫酸和NaOH反应的中和热为-57.3 kJ?mol-1 |
| D、稀醋酸与稀NaOH反应生成1mol水,放出57.3 kJ的热量 |
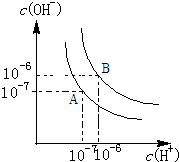 水的电离平衡如图所示.
水的电离平衡如图所示.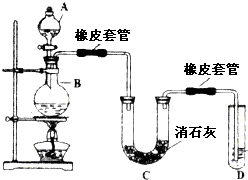 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:

 发生类似反应①的反应,试写出其中一种产物的结构式:
发生类似反应①的反应,试写出其中一种产物的结构式: