题目内容
6.汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质.已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则该反应的热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol.
分析 N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1①
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1②
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1③
根据盖斯定律可得:③×2-①-②,由此分析解答.
解答 解:N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mo1①
2C(s)+O2(g)═2CO(g);△H=-221.0kJ/mo1②
C(s)+O2(g)═CO2(g);△H=-393.5kJ/mo1③
根据盖斯定律可得:③×2-①-②,2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol.
点评 本题考查了热化学方程式,应熟练掌握盖斯定律的计算应用,学会图象分析应用是解题关键,题目难度中等.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
16.常温下,1.0mol/L一元酸HA与等体积等浓度KOH溶液混合,所得溶液粒子的浓度关系如表(不含水分子的5种粒子,A为短周期元素),下列说法正确的是( )
| 粒子 | K+ | A - | X | Y | Z |
| 浓度(mol/L) | 0.50 | 0.49 | c(X)>c(Y)>c(Z) | ||
| A. | 元素A最高价氧化物对应水化物为HAO4 | |
| B. | 表格中X表示HA,Y表示H+ | |
| C. | 所得溶液中c(X)+c(A-)=c(K+) | |
| D. | 等体积等浓度的HA和盐酸分别加水稀释10倍后,pH (HA)>pH(HCl) |
17.下列关于硅酸的说法正确的是( )
| A. | 硅酸可以通过SiO2和水化合反应直接制得 | |
| B. | 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3↓制取硅酸 | |
| C. | 因为硅酸难溶于水,所以它不能与NaOH溶液反应 | |
| D. | 干燥剂“硅胶”的主要成分是硅酸钠 |
1.设NA表示阿伏加德罗常数的值,下列结论中正确的是( )
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 粗铜精炼时,当阳极质量减少6.4g时,电路中转移电子数一定不是0.2NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| D. | 200mL0.5mol/LNa2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA |
11.实脸室取等物质的量的KClO3分别发生下述反应:
反应一:有催化剂存在时,受热分解得到氧气;
反应二:不使用催化剂,加热至743K左右,得到KClO4和KCl.
下列关于①和②的说法正确的是( )
反应一:有催化剂存在时,受热分解得到氧气;
反应二:不使用催化剂,加热至743K左右,得到KClO4和KCl.
下列关于①和②的说法正确的是( )
| A. | 两个反应中都只有一种元素化合价发生改变 | |
| B. | 两个过程生成KCl的物质的量相同 | |
| C. | 发生氧化反应的元素相同 | |
| D. | 发生还原反应的元素相同 |
18.下列几组实验中.能够达到目的是( )
| A. | 实验一:向饱和AlCl3溶液中滴加氨水以制备Al(OH)3胶体 | |
| B. | 实验二:用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| C. | 实验三:用Na2O2与水反应制氧气 | |
| D. | 实验四:用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
15.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法中正确的是( )
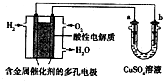

| A. | 燃料电池工作时,正极反应为:O2+4H++4e-═2H2O | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是纯铜,b极是粗铜时,可以达到铜的精炼目的 | |
| D. | a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
5.下列溶液中与200mL 2mol/L CaCl2溶液中Cl-浓度相同的是( )
| A. | 400mL 1mol/L NaCl溶液 | B. | 200mL 2mol/L AlCl3溶液 | ||
| C. | 100mL 1mol/L BaCl2溶液 | D. | 100mL 4mol/L KCl溶液 |

