题目内容
1.设NA表示阿伏加德罗常数的值,下列结论中正确的是( )| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 粗铜精炼时,当阳极质量减少6.4g时,电路中转移电子数一定不是0.2NA | |
| C. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| D. | 200mL0.5mol/LNa2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA |
分析 A、溶液体积不明确;
B、在粗铜的电解精炼中,阳极上放电的除了铜,还有比铜活泼的金属;
C、铜只能与浓硫酸反应,与稀硫酸不反应;
D、CO32-水解导致阴离子个数增多.
解答 解:A、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故A错误;
B、在粗铜的电解精炼中,阳极上放电的除了铜,还有比铜活泼的金属,故当阳极的质量减少6.4g时,电路中转移的电子不一定是0.2NA个,故B正确;
C、铜只能与浓硫酸反应,与稀硫酸不反应,故0.2mol硫酸不能反应完全,故生成的二氧化硫的分子个数小于0.1NA个,故C错误;
D、CO32-水解导致阴离子个数增多:CO32-+H2O?HCO3-+OH-,故溶液中的阴离子个数大于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
12.能正确表示下列反应的离子方程式是( )
| A. | 甲酸钠溶液和盐酸反应:HCOO-+H+═HCOOH | |
| B. | 硫化钠的第一步水解:S2-+2H2O?H2S+2OH- | |
| C. | 醋酸钡溶液和硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O═H3O++CO32- |
9.在中和滴定实验中用到的仪器,只需用蒸馏水洗净不能用待盛放液体润洗的是( )
| A. | 酸式滴定管 | B. | 碱式滴定管 | C. | 移液管 | D. | 锥形瓶 |
16.下列说法正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化 | |
| B. | 太阳能、煤气、潮汐能是一次能源:电力、蒸汽、地热是二次能源 | |
| C. | 吸热反应就是反应物的总能量比生成物的总能量小的反应:也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应 | |
| D. | CO(g)的燃烧热是283.0kJ/mol则2CO2(g)=2CO(g)+O2(g) 反应的△H=+566.0kJ/mol |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 2.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 2.0mol/LNaAlO2溶液:Cl-、HCO3-、K+、ClO- | |
| C. | 某澄清透明的溶液:Fe2+、SO42-、Mg2+、Cl- | |
| D. | c(ClO-)=2.0mol/L的溶液:Na+、I-、S2-、SO42- |
10.下列有机化合物中均含有杂质.除去这些杂质的方法和对应原理都正确的是( )
| 选项 | 杂质方法 | 除杂方法 | 原理 |
| A | 苯中含苯酚杂质 | 加入浓溴水,过滤 | 苯酚能与溴水反应生成白色沉淀 |
| B | 乙酸乙酯中含乙酸杂质 | 加饱和Na2CO3溶液洗涤,分液 | 乙酸乙酯在饱和Na2CO3溶液中的溶解度小且乙酸与Na2CO3反应 |
| C | 除去溴苯中的苯 | 蒸馏 | 苯的沸点比溴苯高 |
| D | 乙醇中含乙酸杂质 | 加入饱和Na2CO3溶液洗涤,分液 | 乙酸能与Na2CO3反应 |
| A. | A | B. | B | C. | C | D. | D |
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 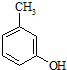 为原料制取.
为原料制取.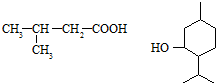 .
.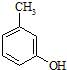 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 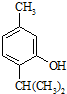 的量远大于生成
的量远大于生成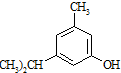 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.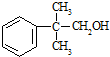 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.