题目内容
19.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)从表中看出,升高温度,K值增大,则CO2的转化率增大,化学反应速率增大.(以上均填“增大”“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是BC
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)由表格数据可知,温度越高K越大,则正反应为吸热反应,升高温度平衡正向移动,反应速率增大;
(3)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),则K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$=1,以此判断温度.
解答 解:(1)由CO2(g)+H2(g)?CO(g)+H2O(g)可知,该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,
故答案为:$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)由表格数据可知,温度越高K越大,则正反应为吸热反应,则升高温度,平衡正向移动,K值增大,则CO2的转化率增大,化学反应速率增大,
故答案为:增大;增大;增大;
(3)A.该反应为气体体积不变的反应,容器中压强始终不变,不能判定平衡状态,故A不选;
B.混合气体中c(CO)不变,浓度不变,为平衡状态,故B选;
C.v正(H2)=v逆(H2O),可知正逆反应速率相等,为平衡状态,故C选;
D.c(CO2)=c(CO)与起始浓度、转化率有关,不能判定平衡状态,故D不选;
故答案为:BC;
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),则K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$=1,结合表格中数据可知,此时的温度为830℃,
故答案为:830.
点评 本题考查化学平衡的计算,为高频考点,把握平衡常数K的意义、平衡移动、平衡判定为解答的关键,侧重分析与应用能力的考查,注意表格数据的应用,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 根据反应MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可检验FeSO4•7H2O是否变质 | |
| B. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| C. | 用湿润的碘化钾淀粉试剂鉴别Br2(g)和NO2 | |
| D. | 用KOH溶液鉴别SO3(g)和SO2 |
| A. | 能发生取代、加成、氧化、加聚等反应 | |
| B. | 1mol该物质能和2molNaOH反应 | |
| C. | 1mol该物质与Br2等物质的量加成可得到三种产物 | |
| D. | 它与足量H2反应可得分子式为C8H18O3的物质 |
| A. | 用米汤检验食用加碘盐(含KIO3)中含有碘 | |
| B. | 用醋、澄清石灰水验证蛋壳中含有碳酸盐 | |
| C. | 用碘酒检验汽油中是否含有不饱和烃 | |
| D. | 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
| A. | NH4+ K+ Ca2+ NO3- | B. | K+ Al3+ Br- NO3- | ||
| C. | Ba2+ K+ SO42- NO3- | D. | H+ K+ SO42- Cl- |
| A. | CH4O | B. | C2H6O | C. | C4H8 | D. | C5H12 |
 如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )
如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )



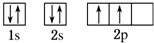 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.