题目内容
20.某同学拟进行除去淀粉溶液中食盐的实验.他把一个鸡蛋泡在醋酸溶液里,待蛋壳溶去,在膜上打一小洞,倒出蛋清和蛋黄,洗净蛋膜,再装入食盐和淀粉的混合溶液并扎好口袋.试回答:(1)做好这些准备后,他即将进行的操作的名称是渗析.
(2)检验烧杯中有无淀粉的方法是在烧杯内液体中加入碘水,若不变蓝,证明无淀粉.
(3)为尽可能将淀粉溶液里的食盐全部除去,可采取的措施是BC(填序号).
A.换大烧杯,用大量水进行(1)操作
B.多次进行(1)操作,每次用水量不必太多
C.将蛋膜放在有流水的水槽中进行进行(1)操作
(4)如何检验淀粉中的食盐有没有全部除去?简述实验过程:加入硝酸银溶液,若无沉淀产生,则已全部去除.
分析 (1)分离胶体和溶液的操作为渗析;
(2)淀粉遇到碘单质会编蓝色;
(3)要获得较纯净的淀粉溶液需要多次操作,即反复水洗;
(4)检验氯化钠的存在,检验氯离子即可,用硝酸银和稀硝酸.
解答 解:(1)鸡蛋壳的内膜是半透膜,可通过渗析来分离淀粉溶液和食盐溶液;
故答案为:渗析;
(2)淀粉遇到碘单质会变蓝色,在烧杯内液体中加入碘水,若不变蓝,证明无淀粉;
故答案为:在烧杯内液体中加入碘水,若不变蓝,证明无淀粉;
(3)要获得较纯净的淀粉溶液需要多次操作,即反复水洗,所以正确的操作为:多次进行渗析操作,每次用水量不必太多;或者将蛋膜放在有流水的水槽中进行进行渗析操作,故BC正确;
故答案为:BC;
(4)检验氯化钠的存在,检验氯离子即可,用硝酸银和稀硝酸检验氯离子,即加入硝酸银溶液,若无沉淀产生,证明没有氯离子,即氯化钠已全部去除;
故答案为:加入硝酸银溶液,若无沉淀产生,则已全部去除.
点评 本题主要考查了物质的分离提纯方法、物质的检验,题目难度不大,注意把握分离提纯胶体的方法,题目很好的培养了分析思维的能力.

练习册系列答案
相关题目
10.在2L密闭容器中,一定条件下发生反应A+3B?2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A. | 0.08mol/(L•s) | B. | 0.02mol/(L•s) | C. | 0.4mol/(L•s) | D. | 0.2mol/(L•s) |
11.下面有关有机物分离和提纯的说话错误的是( )
| A. | 分离、提纯黑芝麻中的黑色素可用萃取的方法 | |
| B. | 分离、提纯含杂质的工业乙醇可用蒸馏的方法 | |
| C. | 分离、提纯粗苯甲酸可用重结晶的方法 | |
| D. | 分离、提纯含有甲苯的苯可用分液的方法 |
15.关于平衡常数K,下列说法中正确的是( )
| A. | K越大,反应速率越大 | |
| B. | 对任一给定的可逆反应,温度升高,K值增大 | |
| C. | 对可逆反应,K值越大,反应物的转化率越高 | |
| D. | 加入催化剂或增大反应物浓度,K值将增大 |
5.下列溶液中的Cl-浓度与100L1mol•L-1MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150L2mol•L-1NaCl溶液 | B. | 70.5L0.5mol•L-1CaCl2溶液 | ||
| C. | 150L2mol•L-1KCl溶液 | D. | 75L2mol•L-1AlCl3溶液 |
12.下列实验方法能达到实验目的是( )
| A. | 用NaOH溶液鉴别SO2和CO2两种气体 | |
| B. | 用湿润的淀粉-KI试纸检验氯化氢中是否混有氯气 | |
| C. | 用BaCl2溶液鉴别Na2SO4和Na2CO3两种溶液 | |
| D. | 用FeCl2溶液检验新制氯水中含有HClO |
10.中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)已知:H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
由此可知焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如表反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
该反应的△H<0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1H2O,2mo1CO2,5mol H2,则此时?正<?逆(填“<”,“>”,“=”).
(4)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
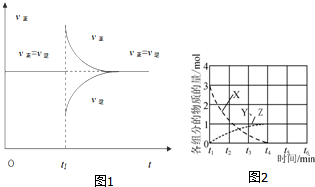
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$(g)+CO2(g)+2H2O(g)△H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(6)在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2.
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)已知:H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
由此可知焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如表反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(4)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A

A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$(g)+CO2(g)+2H2O(g)△H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(6)在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2.