题目内容
11.某氧原子的质最为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
分析 A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值;
B.NA个氧原子的质量就是1mol该原子质量;
C.氧原子的质子数为8,1个氧原子所含的电子数是8个;
D.氧原子的中子数不一定为8.
解答 解:A.某一原子的相对原子质量是指:以一个碳-12原子质量的$\frac{1}{12}$作为标准,该原子的质量跟一个碳-12原子质量的1/12的比值,故该氧原子的相对原子质量为$\frac{12a}{b}$,即该氧原子的摩尔质量为$\frac{12a}{b}$g/mol,故A错误;
B.氧原子的质量为ag,NA个氧原子的质量为aNAg,故B正确;
C.一个该氧原子的质量是a,xg该氧原子个数为X/ag.1个氧原子所含的中子数是8个,则xg该氧原子所含的电子数为$\frac{8x}{a}$,故C错误;
D.氧原子有多种,中子数不一定是8,故D错误.
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 用石墨作电极电解AlC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++4 O2↑+6H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br -+2NO3-+8H+═3Br2+2NO↑+4H2O |
2.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 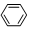 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$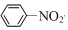 +H2O +H2O |
19.下列事实与胶体的性质无关的是( )
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 | |
| C. | 在河流入海处易形成沙洲 | |
| D. | 在豆浆中加入盐卤制豆腐 |
6.现有常温下的四种溶液(如表),下列有关叙述正确的是( )
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
20.下列有关实验装置或原理正确的是( )


| A. | 利用图1装置可定量测定H2O2的分解速率 | |
| B. | 图2中E1表示使用催化剂后的反应热 | |
| C. | 图3表示在平衡体系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 | |
| D. | 图4表示弱电解质在水中建立电离平衡的过程 |
14.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)

②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).