题目内容
19.硫单质及其化合物在工农业生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△=+210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△=-47.3kJ•mol-1
反应:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-399.7kJ•mol-1
平衡常数K的表达式为$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$.
(2)图1为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系.
图1中压强P1、P2、P3的大小顺序为P1<P2<P3,理由是反应前后气体体积增大,增大压强,平衡逆向进行,该反应平衡常数的大小关系为K(T1)<K(T2)(“>”“=”或“<”),理由是反应是吸热反应,升温,平衡正向进行,平衡常数增大
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)?2SO3△H<0
①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的15-20min和25-30min时间段所示
②据图2判断,反应进行至20min时,曲线发生变化的原因是增大氧气的浓度(用文字表达):10min到15min的曲线变化的原因可能是AB(填写编号)
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示)
分析 (1)①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△=+210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△=-47.3kJ•mol-1
结合盖斯定律可知,②×4-①得到CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g),K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)发生2H2S(g)?2H2(g)+S2(g),该反应为气体体积增大的反应,增大压强平衡逆向移动,转化率减小;由图可知,温度越高,转化率越大;
(3)①平衡时物质的量不发生变化;
②反应进行至20min时,氧气的浓度瞬间增大;10min到15min的曲线斜率增大,反应速率加快,且反应物浓度减小;
(4)得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,存在c(H+)=c(OH-),c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-).
解答 解:(1)(1)①CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△=+210.5kJ•mol-1
②$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△=-47.3kJ•mol-1
结合盖斯定律可知,②×4-①得到CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g),
则△H=(-47.3kJ•mol-1)×4-(+210.5kJ•mol-1)=-399.7kJ/mol;
K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$,
故答案为:-399.7;$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$;
(2)图1中压强P1、P2、P3的大小顺序为P1<P2<P3;理由是反应前后气体体积增大,增大压强,平衡逆向进行;由图可知,温度越高,转化率越大,则该反应为吸热反应,升高温度,K增大,即K(T1)<K(T2),
故答案为:P1<P2<P3;反应前后气体体积增大,增大压强,平衡逆向进行;<;反应是吸热反应,升温,平衡正向进行,平衡常数增大;
(3)①平衡时物质的量不变,则反应处于平衡状态的15-20min和25-30min时间段所示,故答案为:15-20min和25-30min;
②反应进行至20min时,氧气的浓度瞬间增大,则曲线发生变化的原因是增大氧气的浓度;10min到15min的曲线斜率增大,反应速率加快,反应物浓度减小,加催化剂、缩小体积均符合,C中降低温度,反应速率减小,D中二氧化硫浓度增大,故选AB,
故答案为:增大氧气的浓度;AB;
(4)得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,存在c(H+)=c(OH-),c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),则c(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-).
点评 本题考查化学平衡的计算,为高频考点,把握盖斯定律应用、图象及平衡移动、离子浓度关系为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 向某溶液中加入AgNO3溶液,可生成白色沉淀,加稀盐酸沉淀不消失,则可确定该溶液中一定含有Cl-, | |
| B. | 用试管加热碳酸氢钠固体时试管口竖直向上 | |
| C. | 实验室需要800mL0.1mol•L-1NaOH溶液,需要称取4.0gNaOH进行配制 | |
| D. | 实验室中可用碱石灰干燥氯气 |
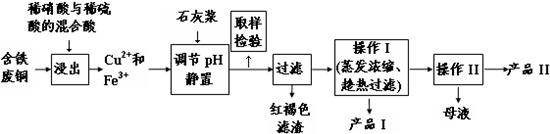
相关物质在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红褐色滤渣的主要成分是Fe(OH)3(写化学式).
(2)在进行操作I时的最佳温度是100℃.
(3)从溶液中分离出产品Ⅱ的操作Ⅱ应为冷却结晶、过滤、洗涤、干燥.
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色.为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、
H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和过量 (填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗 (填仪器)中,倒入一定量的CCl4, 塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)

②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
| A. | 碳酸钡与盐酸反应 2H++BaCO3=Ba2++H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸混合 Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O=Cl-+ClO-+2 H+ | |
| D. | CO2通入过量的澄清石灰水中 CO2+Ca(OH)2=CaCO3↓+H2O |
| A. | 若生成物C、D中有一种为单质,则该反应一定是置换反应 | |
| B. | 若生成物C和D分别为两种沉淀,A、B有可能为盐和碱 | |
| C. | 若C、D是盐和水,则A、B一定是酸和碱 | |
| D. | 若C、D是两种化合物,则A、B一定是化合物 |
| A. | 铝用于制造电缆 | B. | 硝酸用于制造化肥 | ||
| C. | 常温下用铁制容器盛装浓硫酸 | D. | 四氧化三铁用作红色油漆 |

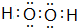 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-
,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-