题目内容
6.为了探究Cl2、SO2同时通入H2O中发生飞反应,某化学兴趣小组同学设计了如下图所示的实验装置.
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.在此实验中,F仪器的作用是:防止倒吸;发生装置B应选择三种装置中的①(填序号).
(2)D装置中主要反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.
(3)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液.
a.若Cl2过量:取适量D中溶液滴加至盛有②(选填一个序号)试剂的试管内,再加入③或④(选填一个序号)试剂,发生的现象是:溶液变为红色或是紫色;
b.若SO2过量:取适量D中溶液滴加至盛有⑤(选填一个序号)试剂的试管内,发生的现象是:溶液变成无色.
分析 由装置可知,A中Na2SO3与70%的浓硫酸为原料制取SO2,B中MnO2和浓盐酸(12mol/L)为原料制取Cl2,C中饱和食盐水除去氯气中的HCl,D中发生SO2+Cl2+2H2O=SO2-4+2Cl-+4H+,E为尾气处理,制备氯气为固体、液体反应且加热装置,F中球形结构可防止倒吸.
(1)制备氯气为固体、液体反应且加热装置,F中球形结构可防止倒吸;
(2)D装置中主要反应为二氧化硫和氯气在水溶液中反应生成硫酸和氯化氢;
(3)氯气具有氧化性,能将亚铁离子氧化为铁离子,铁离子遇到硫氰化钾显示红色,遇到酚酞显示紫色;二氧化硫具有还原性,能被高锰酸钾氧化.
解答 解:由装置可知,A中Na2SO3与70%的浓硫酸为原料制取SO2,B中MnO2和浓盐酸(12mol/L)为原料制取Cl2,C中饱和食盐水除去氯气中的HCl,D中发生SO2+Cl2+2H2O=SO42-+2Cl-+4H+,E为尾气处理,
(1)制备氯气为固体、液体反应且加热装置,发生装置B应选择三种装置中的①,F中球形结构可防止倒吸,则F的作用为防止倒吸,
故答案为:防止倒吸;①;
(2)D装置中主要反应的离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+,
故答案为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(3)a.若Cl2过量,因为氯气具有氧化性,能将亚铁离子氧化为铁离子,可以取适量D中溶液滴氯化亚铁,这样亚铁离子氧化为铁离子,加入硫氰化钾或是酚酞,铁离子遇到硫氰化钾显示红色,遇到酚酞显示紫色,局颜色可以判断氯气的存在,
故答案为:②;③或④;溶液呈红色或是紫色;
b.二氧化硫具有还原性,若SO2过量,加入高锰酸钾,二氧化硫和高锰酸钾之间发生氧化还原反应,使得高锰酸钾褪色,据此确定二氧化硫过量,
故答案为:⑤;溶液变成无色.
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、气体的制备实验、物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 | |
| B. | 用排水集气法便可以收集到氯气 | |
| C. | 氯气有漂白性 | |
| D. | 自来水常用氯气来杀菌、消毒 |
| 共价键 | N-N | N-H | O=O | N≡N |
| 键能kJ•mol-1 | 3a | 2.5a | 4a | 8a |
| A. | 2a kJ•mol-1 | B. | 2.5a kJ•mol-1 | C. | 3a kJ•mol-1 | D. | 3.5a kJ•mol-1 |
①NH4H是离子化合物,含有离子键和共价键
②NH4H溶于水,所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂
④NH4H固体投入少量水中,有两种气体产生.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
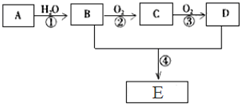 已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.