题目内容
16.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
分析 A.物质的量n=$\frac{m}{M}$,C原子含有6个电子;
B.标准状况下四氯化碳不是气体;
C.标准状况下气体物质的量n=$\frac{V}{22.4}$,N2和H2都是双原子分子据此计算含有的原子数;
D.物质的量n=$\frac{N}{{N}_{A}}$,1个水分子含有一个氧原子,2个氢原子.
解答 解:A.物质的量n=$\frac{m}{M}$=$\frac{18g}{12g/mol}$=1.5mol,1个C原子含有6个电子,则1.5molC原子含电子数1.5×6×NA=9NA,故A正确;
B.标准状况下四氯化碳不是气体,22.4LCCl4物质的量不是1mol,故B错误;
C.标准状况下气体物质的量n=$\frac{V}{22.4}$=$\frac{33.6L}{22.4L/mol}$=1.5mol,N2和H2都是双原子分子,1.5molN2和H2的混合气体中含3NA个原子,故C正确;
D.物质的量n=$\frac{N}{{N}_{A}}$=$\frac{2.709×1{0}^{24}}{6.02×1{0}^{23}}$=4.5mol,水分子物质的量=$\frac{4.5mol}{3}$=1.5mol,1个水分子含有一个氧原子,1.5mol水分子含有1.5NA个氧原子,故D正确;
故选B.
点评 本题考查了了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用、物质的量和微粒数的计算等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
7.在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示.下列说法错误的是( )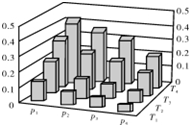

| A. | P1>P2>P3>P4 | |
| B. | 甲醇的物质的量分数越高,反应的平衡常数越大 | |
| C. | 若T1>T2>T3>T4,则该反应为放热反应 | |
| D. | 缩小容积,可以提高CH3OH在混合物中的质量分数 |
11.把3体积NO2气体依次通过①饱和NaHCO3溶液,②浓硫酸,③Na2O2后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )
| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
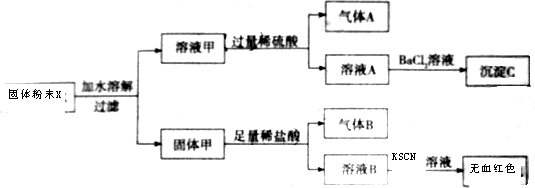
1.把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平):

下列关于该离子方程式的说法不正确的是( )

下列关于该离子方程式的说法不正确的是( )
| A. | IO${\;}_{4}^{-}$作氧化剂 | |
| B. | 氧化性:Mn2+>IO${\;}_{3}^{-}$ | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 若有2mol Mn2+参加反应,则转移10mol电子 |
8.黑火药是我国古代四大发明之一,其爆炸时发生反应的化学方程式为:S+2KNO3+3C=K2S+N2↑+3CO2↑.设该反应中转移的电子数为amol,被2molKNO3氧化而成的氧化产物为bmol,则a、b的值分别为( )
| A. | 12,2.5 | B. | 24,2.5 | C. | 12,3.0 | D. | 24,3.0 |
16.我国东海发现大型油田.下列关于石油的说法中正确的是( )
| A. | 石油属于可再生矿物能源 | B. | 石油主要含有碳、氢两种元素 | ||
| C. | 石油的裂化是物理变化 | D. | 石油分馏的各馏分均是纯净物 |

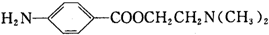 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):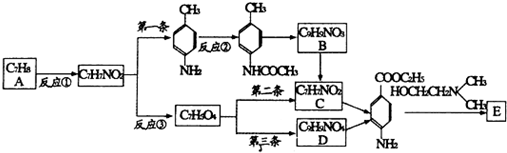
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH. .
.