题目内容
已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9.不同温度下水的离子积常数见下表:
(1)常温下将0.2mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为 ;
(2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,试写出反应的离子方程式: ;
若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,溶液颜色的变化是 ;若共消耗VmL高锰酸钾溶液,则草酸的物质的量浓度为 mol/L.
(2)90℃时,将0.005mol/L的氢氧化钙溶液20mL与0.0012mol/L的草酸溶液20mL混合,则混合后溶液中各离子浓度的大小顺序为 ;
(3)25℃时向氢氧化钙溶液中加入0.1mol/L碳酸钠溶液充分搅拌,有白色的碳酸钙沉淀生成,当溶液的pH=11时,c(CO32-)= mol/L;
若向20mL草酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的碳酸钾溶液10mL,能否产生沉淀, (填“能”或“否”).
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
(2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,试写出反应的离子方程式:
若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,溶液颜色的变化是
(2)90℃时,将0.005mol/L的氢氧化钙溶液20mL与0.0012mol/L的草酸溶液20mL混合,则混合后溶液中各离子浓度的大小顺序为
(3)25℃时向氢氧化钙溶液中加入0.1mol/L碳酸钠溶液充分搅拌,有白色的碳酸钙沉淀生成,当溶液的pH=11时,c(CO32-)=
若向20mL草酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的碳酸钾溶液10mL,能否产生沉淀,
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)两溶液恰好反应生成草酸氢钾,根据草酸氢根离子的水解程度小于电离程度判断溶液中离子浓度大小;
(2)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;设草酸的物质的量浓度为xmol/L,根据反应中高锰酸钾和草酸的物质的量的关系来求解;
(3)根据混合后溶液中氢氧化钙过量,溶液呈碱性来判断;
(4)根据氢氧化钙溶液的pH=11,求出溶液中C(OH-)和C(Ca2+),根据的碳酸钙的Ksp求出c(CO32-);根据草酸钙的Ksp求出C(Ca2+),根据离子积Qc与碳酸钙的Ksp的大小比较判断有无沉淀生成.
(2)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;设草酸的物质的量浓度为xmol/L,根据反应中高锰酸钾和草酸的物质的量的关系来求解;
(3)根据混合后溶液中氢氧化钙过量,溶液呈碱性来判断;
(4)根据氢氧化钙溶液的pH=11,求出溶液中C(OH-)和C(Ca2+),根据的碳酸钙的Ksp求出c(CO32-);根据草酸钙的Ksp求出C(Ca2+),根据离子积Qc与碳酸钙的Ksp的大小比较判断有无沉淀生成.
解答:
解:(1)常温下将0.2mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,反应生成草酸氢钾,由于草酸氢根离子的电离程度远远大于其水解程度,所以溶液显示酸性,c(H+)>c(OH-) 溶液中离子浓度大小为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色;设草酸的物质的量浓度为xmol/L,根据反应:2MnO4-+5H2C2O4 +6H+=2Mn2++10CO2↑+8H2O
2 5
10-4Vmol 0.02Xmol
可得:
=
解得X=
mol/L
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
;
(3)0.005mol/L 20mL的氢氧化钙溶液中氢氧化钙的物质的量n=CV=0.005mol/L×0.02L=10-4mol/L,0.0012mol/L 20mL的草酸溶液中草酸的物质的量为0.24×10-4mol/L,根据草酸与氢氧化钙的反应可知,氢氧化钙过量,草酸完全反应,故溶液中离子浓度最大的为OH-,其次为Ca2+,最小的为H+,
故答案为:c(OH-)>c(Ca2+)>c(H+);
(4)氢氧化钙溶液的pH=11,可知溶液中C(OH-)=10-3mol/L,C(Ca2+)=
×10-3mol/L=5×10-4mol/L,因为有白色的碳酸钙沉淀生成,即得到碳酸钙的饱和溶液,大其溶解平衡,根据碳酸钙的Ksp=c(CO32-)×C(Ca2+)=2.5×10-9,可知c(CO32-)=5×10-6mol/L;在草酸钙的饱和溶液中,c(C2O42-)=C(Ca2+),根据草酸钙的Ksp=4.0×10-8,可知C(Ca2+)=2×10-4mol/L,若向20mL草酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的碳酸钾溶液10mL后,由于溶液体积的变化,
C(Ca2+)=2×10-4mol/L×
=
×10-4mol/L,c(CO32-)=8.0×10-4mol/L×
=
×10-4mol/L,故浓度积Qc=c(Ca2+)?c (CO32-)=3.6×10-8>Ksp(2.5×10-9),故有沉淀产生,故答案为:5.0×10-6;能.
故答案为:c(K+)>c( HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色;设草酸的物质的量浓度为xmol/L,根据反应:2MnO4-+5H2C2O4 +6H+=2Mn2++10CO2↑+8H2O
2 5
10-4Vmol 0.02Xmol
可得:
| 2 |
| 10-4V |
| 5 |
| 0.02X |
解得X=
| V |
| 80 |
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
| V |
| 80 |
(3)0.005mol/L 20mL的氢氧化钙溶液中氢氧化钙的物质的量n=CV=0.005mol/L×0.02L=10-4mol/L,0.0012mol/L 20mL的草酸溶液中草酸的物质的量为0.24×10-4mol/L,根据草酸与氢氧化钙的反应可知,氢氧化钙过量,草酸完全反应,故溶液中离子浓度最大的为OH-,其次为Ca2+,最小的为H+,
故答案为:c(OH-)>c(Ca2+)>c(H+);
(4)氢氧化钙溶液的pH=11,可知溶液中C(OH-)=10-3mol/L,C(Ca2+)=
| 1 |
| 2 |
C(Ca2+)=2×10-4mol/L×
| 2 |
| 3 |
| 4 |
| 3 |
| 1 |
| 3 |
| 8 |
| 3 |
点评:本题考查了盐溶液中离子浓度大小比较、氧化还原反应方程式的书写以及沉淀的溶解平衡等内容,难度较大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
下列叙述中正确的是( )
| A、含氧酸具有氧化性,无氧酸则不具有氧化性 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
下列方程式书写正确的是( )
| A、HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CuSO4的水解方程式:Cu2++2H2O?Cu(OH)2+2H+ |
下列各组物质中,按酸、碱、盐的顺序排列正确的是( )
| A、氢硫酸、烧碱、明矾 |
| B、硫酸、纯碱、石膏 |
| C、硝酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
已知同温同压下,下列反应的焓变和平衡常数分别表示为
H2(g)+
O2(g)=H2O(g)△H1 K1
N2(g)+O2(g)=NO2(g)△H2 K2
N2(g)+
H2(g)=NH3(g)△H3 K3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的△H和K分别为( )
H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
则反应2NH3(g)+
| 7 |
| 2 |
| A、2△H1+2△H2-2△H3 3K1+2K2-2K3 | ||||||||
B、2△H3-3△H1-2△H2
| ||||||||
C、3△H1+2△H2-2△H3
| ||||||||
| D、3△H1+2△H2-2△H3 3K1+2K2-2K3 |
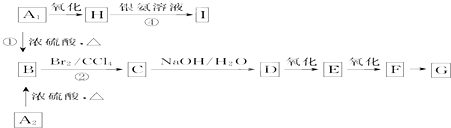
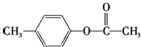 、
、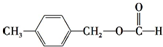 外,其余的结构简式为
外,其余的结构简式为