题目内容
9.在体积固定的密闭容器中,发生反应2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g).下列叙述说明该反应已达到化学平衡状态的是( )| A. | 混合气体密度不变 | |
| B. | 体系压强不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 反应体系中乙醇的物质的量浓度不再变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、体积固定的密闭容器中,反应体系都是气体,所以混合气体的密度始终不变,故A错误;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故B正确;
C、混合气体的平均相对分子质量不变,说明气体的物质的量不变反应达平衡状态,故C正确;
D、反应体系中乙醇的物质的量浓度不再变化,说明乙醇的物质的量不变,正逆反应速率相等,反应达平衡状态,故D正确;
故选BCD.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在KNO3、MgSO4、K2SO4组成的混合溶液中Mg2+0.5mol、NO3-0.2mol、SO42-0.6mol,则溶液中K+的物质的量为( )
| A. | 0.4mol | B. | 0.3mol | C. | 0.2mol | D. | 0.1mol |
20.某研究性学习小组为测定花溪河水中 Ca2+的含量,取样 100mL,经测定其中含 Ca2+的质量为 4mg,则该河水中 Ca的物质的量浓度为( )
| A. | 1×10-4mol/L | B. | 1×10-3mol/L | C. | 4×10-4mol/L | D. | 4×10-3mol/L |
17.柠檬烯是一种食用香料,其结构简式为: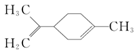 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它在核磁共振氢谱中有6个峰 | B. | 它能发生取代、加成和氧化反应 | ||
| C. | 它与丁基苯互为同分异构体 | D. | 它属于芳香族化合物 |
4.下有关事实或解释均正确的是( )
| 选项 | 事 实 | 解 释 |
| A | 锌与盐酸反应,加入氯化钠溶液,速率加快 | 增大了氯离子的浓度,使反应速率增加 |
| B | 锌与稀硫酸反应,加入较多硫酸铜溶液,生成氢气的速率加快 | 形成铜锌原电池,使生成氢气的速率加快 |
| C | 在5%的双氧水中加入二氧化锰粉末,分解速率迅速加快 | 降低了反应的焓变,活化分子数增多,有效碰撞增多,反应速率加快 |
| D | 面粉成产车间容易发生爆炸 | 固体表面积大,反应速率加快 |
| A. | A | B. | B | C. | C | D. | D |
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )


| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入HCl溶液可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
5.下列各组可用同种方法除去杂质(括号内物质)的是( )
| A. | 植物油(水)与乙醇(水) | B. | 蛋白质溶液(NaCl)与淀粉溶液(KI) | ||
| C. | 泥水(淀粉溶液)与Fe(OH)3胶体(FeCl3) | D. | 氧化钙(碳酸钙)与NaHCO3 (Na2CO3) |
6.氢化亚铜(CuH)是一种难溶物,能在Cl2中燃烧生成CuCl2和HCl,与盐酸反应生成CuCl和H2.下列关于氢化亚铜的推断正确的是( )
| A. | CuH与盐酸的反应属于置换反应 | |
| B. | CuH在Cl2中燃烧,1molCuH转移电子数为2NA | |
| C. | CuH在Cl2中燃烧时铜元素和氢元素均被氧化 | |
| D. | CuH与盐酸反应的离子方程式:H-+H+═H2↑ |