题目内容
20.某研究性学习小组为测定花溪河水中 Ca2+的含量,取样 100mL,经测定其中含 Ca2+的质量为 4mg,则该河水中 Ca的物质的量浓度为( )| A. | 1×10-4mol/L | B. | 1×10-3mol/L | C. | 4×10-4mol/L | D. | 4×10-3mol/L |
分析 根据n=$\frac{m}{M}$计算出4mg钙离子的物质的量,然后根据c=$\frac{n}{V}$计算出该河水中Ca2+的物质的量浓度.
解答 解:4mgCa2+的物质的量为:$\frac{4×1{0}^{-3}g}{40g/mol}$=1×10-4mol,则该河水中Ca2+的物质的量浓度为:$\frac{1×1{0}^{-4}mol}{0.1L}$=1×10-3mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.下列有关物质的性质与用途具有对应关系的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | MgO、Al2O3的熔点都很高,都可用作耐火材料 |
8.下列物质按照单质、氧化物、混合物的顺序排列的是( )
| A. | 铁、氧化铁、氯化铁 | B. | 冰、干冰、可燃冰 | ||
| C. | 氧气、二氧化碳、空气 | D. | 金刚石、铁矿石、石灰石 |
15. A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
 A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、p、n分别是元素A、B、C的单质,x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且x是用于配制饮料,它们之间有如图转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )| A. | D的单质起火燃烧时可用x作灭火剂 | |
| B. | 元素的非金属性:C>A>B>D | |
| C. | B、C、D与A形成的简单化合物的熔点:C>D>B | |
| D. | 原子半径:D>B>C>A |
5.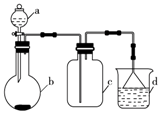 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.在空气中,下列有机物完全燃烧的产物不都是氧化物的是( )
| A. | 氯乙烯 | B. | 丙烷 | C. | 苯 | D. | 乙醇 |
9.在体积固定的密闭容器中,发生反应2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g).下列叙述说明该反应已达到化学平衡状态的是( )
| A. | 混合气体密度不变 | |
| B. | 体系压强不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 反应体系中乙醇的物质的量浓度不再变化 |
17.下列表示正确的是( )
| A. | 氯化钠的电子式: | B. | 二氧化碳的结构式:O-C-O | ||
| C. | S2-的结构示意图: | D. | 葡萄糖的分子式:C6H12O6 |
 某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催
某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催