题目内容
12.标准状况下2.24LSO2与1L0.15mol•L-1的NaOH溶液反应,反应后溶液中的溶质是( )| A. | NaHSO3 | B. | NaOH和Na2SO3 | C. | Na2SO3 | D. | Na2SO3和NaHSO3 |
分析 标准状况下2.24LSO2的物质的量为:0.1mol,1L0.15mol•L-1的NaOH溶液的物质的量为:1L×0.15mol•L-1=0.15mol,$1<\frac{n(NaOH)}{n(S{O}_{2})}=\frac{3}{2}<2$,由此分析解答.
解答 解:标准状况下2.24LSO2的物质的量为:0.1mol,1L0.15mol•L-1的NaOH溶液的物质的量为:1L×0.15mol•L-1=0.15mol,$1<\frac{n(NaOH)}{n(S{O}_{2})}=\frac{3}{2}<2$,得到Na2SO3和NaHSO3的混合溶液,故选D.
点评 本题考查物质的量有关计算和混合反应后溶质成份的分析,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
3.下列判断错误的是( )
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Si3N4>NaCl>Sil4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
20.实验室需要用480mL 0.1mol•L-1的硫酸铜溶液,以下配制方法正确的是( )
| A. | 称取12.5 g胆矾(CuSO4•5H2O),配成500 mL溶液 | |
| B. | 称取12.5 g胆矾(CuSO4•5H2O),加入500 mL水配成溶液 | |
| C. | 称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液 | |
| D. | 称取8.0 g无水硫酸铜粉末,加入500 mL水配成溶液 |
7.表中相关的评价合理的是( )
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5molN2和1.5molH2反应,平衡时放热akJ, 则N2(g)+3H2(g)?2NH3(g)+2aKJ | 正确 |
| B | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | 错误,氨水不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-→BaSO4↓ | 正确 |
| D | 等物质的量的Cl2与Na2SO3在溶液中反应:SO32-+Cl2→SO42-+2Cl- | 正确 |
| A. | A | B. | B | C. | C | D. | D |
17.Cu和浓H2SO4反应得到25gCuSO4•5H2O,被还原的H2SO4是( )
| A. | 4.9g | B. | 8.0g | C. | 9.8g | D. | 19.6g |
4.下列各溶液中一定能大量共存的离子组是( )
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
1.下列说法不正确的是( )
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
2.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | A与C形成的化合物溶于水所得溶液显碱性 | |
| B. | B与D形成的化合物溶于水所得溶液显酸性 | |
| C. | 氢化物的稳定性:C>D | |
| D. | 简单离子的半径:B>C>D>A |
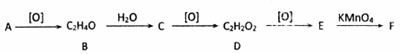
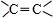 ,其产量可以用来衡量一个国家石油化工的发展水平.
,其产量可以用来衡量一个国家石油化工的发展水平.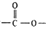 ,且无环状结构的同分异构体有8种.(不考虑立体异构)
,且无环状结构的同分异构体有8种.(不考虑立体异构)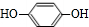 .
.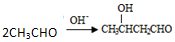 .
.