题目内容
20.实验室需要用480mL 0.1mol•L-1的硫酸铜溶液,以下配制方法正确的是( )| A. | 称取12.5 g胆矾(CuSO4•5H2O),配成500 mL溶液 | |
| B. | 称取12.5 g胆矾(CuSO4•5H2O),加入500 mL水配成溶液 | |
| C. | 称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液 | |
| D. | 称取8.0 g无水硫酸铜粉末,加入500 mL水配成溶液 |
分析 实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;配制溶液的体积为500mL,需要硫酸铜物质的量等于硫酸铜晶体的物质的量,根据m=cVM计算所需硫酸铜的质量或硫酸铜晶体的质量,据此判断.注意500mL是溶液的体积,不是溶剂的体积为500mL,据此进行解答.
解答 解:实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;需要硫酸铜的质量为:0.1mol•L-1×0.5L×160g/mol=8.0g,需要胆矾的质量为:0.1mol•L-1×0.5L×250g/mol=12.5g,
A.根据分析可知,需要称取12.5 g胆矾(CuSO4•5H2O),配成500 mL溶液,故A正确;
B.溶液的体积是500mL,不是溶剂的体积为500mL,故B错误;
C.实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶,故C错误;
D.溶液的体积是500mL,不是水的体积为500mL,故D错误;
故选A.
点评 本题考查了溶液配制,题目难度不大,正确判断容量瓶规格为解答关键,注意掌握配制一定物质的量浓度的溶液方法,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
1.下列离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2═SO42- | |
| C. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
15.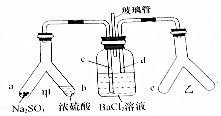 Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
 Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )| A. | 玻璃管的作用是连通大气,使空气中的氧气进人广口瓶,参与反应 | |
| B. | c、d两根导管郡必须插人BaCl2溶液中,保证气体与Ba2+充分接触 | |
| C. | Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀 | |
| D. | e、f两管中的试剂可以分别是浓氨水和NaOH |
5.据报道,结构式为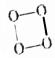 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A. | O4与O3、O2互为同素异形体 | |
| B. | O4与H2反应生成冰 | |
| C. | O4中各原子最外电子层均达到8电子结构 | |
| D. | O4的化学性质一定比O2稳定 |
12.标准状况下2.24LSO2与1L0.15mol•L-1的NaOH溶液反应,反应后溶液中的溶质是( )
| A. | NaHSO3 | B. | NaOH和Na2SO3 | C. | Na2SO3 | D. | Na2SO3和NaHSO3 |
9.如图为用含少量铁的废铜渣为原料生产胆矾的流程:

金属离子沉淀的pH
(1)写出浸出时铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)在浸出时加入稀硫酸的作用提供酸性环境,使NO3-氧化铜
(3)试剂b为CuO或Cu(OH)2;滤渣c为Fe(OH)3.
(4)取样检验是为了证明没有Fe3+存在,其方法是向试样中滴加KSCN溶液,无明显现象.
(5)从滤液中得到胆矾的操作是蒸发浓缩、冷却结晶、过滤
(6)气体 a 可以被循环利用,用化学方程式表示气体 a 被循环利用的原理为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO.
(7)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和 O2气体,且n (SO3):n (SO2)=1:2,写出硫酸铜受热分解的化学方程式3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.

金属离子沉淀的pH
| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)在浸出时加入稀硫酸的作用提供酸性环境,使NO3-氧化铜
(3)试剂b为CuO或Cu(OH)2;滤渣c为Fe(OH)3.
(4)取样检验是为了证明没有Fe3+存在,其方法是向试样中滴加KSCN溶液,无明显现象.
(5)从滤液中得到胆矾的操作是蒸发浓缩、冷却结晶、过滤
(6)气体 a 可以被循环利用,用化学方程式表示气体 a 被循环利用的原理为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO.
(7)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和 O2气体,且n (SO3):n (SO2)=1:2,写出硫酸铜受热分解的化学方程式3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.
10.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al2O3$→_{△}^{NaOH}$NaAlO2(ap)$\stackrel{CO_{2}}{→}$Al(OH)3(s) | |
| C. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3(ap) | |
| D. | Cu$→_{H_{2}SO_{4},△}^{O_{2}}$CuSO4(ap)$→_{△}^{过量NaOH(ap),葡萄糖}$CuO(s) |
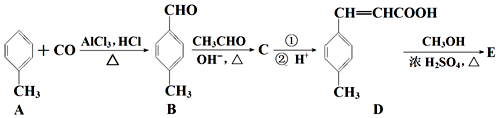
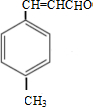 ;D→E的反应类型为酯化反应.
;D→E的反应类型为酯化反应.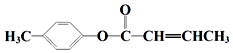 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为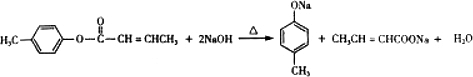 .
. .
.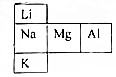 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出: