题目内容
14.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
| A. | 每生成2molAB吸收b kJ热量 | |
| B. | 该反应热△H=(b-a)kJ•mol-1 | |
| C. | 该反应为吸热反应 | |
| D. | 断裂1 mol A-A和1 mol B-B键放出a kJ能量 |
分析 A.依据图象分析判断1molA2和1molB2反应生成2molAB,能量变化为(a-b);
B.反应热△H=反应物能量总和-生成物能量总和;
C.由图象知,反应物的能量低于生成物的能量;
D.断键吸收能量.
解答 解:A.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,则每生成2molAB吸收(a-b) kJ热量,故A错误;
B.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,故B错误;
C.由图象可知,该反应中反应物的能量低于生成物的能量,所以反应是吸热反应,故C正确;
D.因旧键的断裂吸收能量,由图可知断裂1 mol A-A和1 mol B-B键吸收a kJ能量,故D错误;
故选C.
点评 本题考查了化学反应的能量变化、图象分析判断,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单,明确放热反应与吸热反应的区别是解题的关键.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
12.某物质具有较低的熔点和沸点,且又难溶于水,这种物质可能是( )
| A. | 原子晶体 | B. | 非极性分子型物质 | ||
| C. | 极性分子型物质 | D. | 离子晶体 |
6.已知强酸与强碱在稀溶液里发生中和反应生成1mol H2O 时放出57.3kJ热量,用500mL 0.6mol•L-1的稀硫酸跟含1mol NaOH的溶液反应,放出的热量是( )
| A. | 68.76 kJ | B. | 57.3 kJ | C. | 34.38 kJ | D. | 17.19 kJ |
3.下列反应的离子方程式书写正确的是( )
| A. | 用NaOH溶液吸收少量CO2 CO2+OH-=CO32-+H2O | |
| B. | 盐酸滴在铜片上 Cu+2H+=Cu2++H2O | |
| C. | H2SO4与Ba(OH)2溶液反应 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | CaCl2溶液中通入CO2 Ca2++CO2+H2O=CaCO3↓+2H+ |
4.下列除杂试剂选择正确的是( )
| 物质(杂质) | 除杂试剂 | |
| A | NaHCO3(Na2CO3) | 稀盐酸 |
| B | CO2(HCl) | 饱和碳酸钠溶液 |
| C | NH3(H2O) | 浓硫酸 |
| D | Fe3+(Fe2+) | 过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |
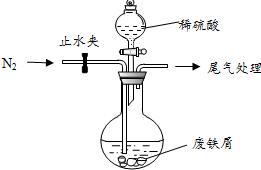 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
 .
.