题目内容
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.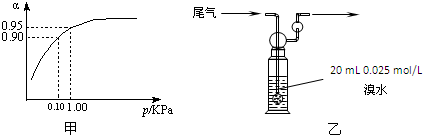
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为 .
(2)在恒温恒容的密闭容器中,充入一定量的SO2和O2发生反应,下列状态说明反应达到限度的是 (填字母).
A.c(SO2)=c(SO3)的状态
B.混合气体平均分子量保持不变的状态
C.单位时间生成2n mol的SO2同时生成n mol的O2的状态
D.V(SO2)正=2V(O2)逆的状态
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.试分析工业生产中采用常压的原因是 .
(4)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于 (填字母).
A.40% B.50% C.80% D.90%
20mL 0.025mol/L溴水尾气
(5)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用图乙所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,溶液恰好褪色.则该尾气中二氧化硫含量(体积分数)为
(6)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.
则:α1+α2= ,p= mol,b+c= kJ.

2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为
(2)在恒温恒容的密闭容器中,充入一定量的SO2和O2发生反应,下列状态说明反应达到限度的是
A.c(SO2)=c(SO3)的状态
B.混合气体平均分子量保持不变的状态
C.单位时间生成2n mol的SO2同时生成n mol的O2的状态
D.V(SO2)正=2V(O2)逆的状态
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.试分析工业生产中采用常压的原因是
(4)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
20mL 0.025mol/L溴水尾气
(5)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用图乙所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,溶液恰好褪色.则该尾气中二氧化硫含量(体积分数)为
(6)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
考点:热化学方程式,化学平衡的影响因素,化学平衡状态的判断,等效平衡
专题:基本概念与基本理论
分析:(1)根据钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4,可看出钒元素的化合价从+5价降为+4价,所以,二氧化硫中的硫从+4价上升为+5价;
(2)依据化学平衡标志是正逆反应速率相同,各成分含量保持不变,据此分析判断选项;
(3)从图象中可以看出,当压强为0.1KPa时,SO2的转化率为0.90,当压强为1.0KPa时,SO2的转化率为0.95;
(4)由2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1,则1mol SO2完全反应,放出98.2kJ的热量,利用物质的量与放出的热量成正比计算反应的二氧化硫,以此计算SO2的转化率;
(5)计算二氧化硫的含量,根据硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时不能任意排放来回答;
(6)2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1,该反应为放热反应,恒温、恒容,放出的能量以及转化率与参加反应的物质的物质的量成正比.
(2)依据化学平衡标志是正逆反应速率相同,各成分含量保持不变,据此分析判断选项;
(3)从图象中可以看出,当压强为0.1KPa时,SO2的转化率为0.90,当压强为1.0KPa时,SO2的转化率为0.95;
(4)由2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1,则1mol SO2完全反应,放出98.2kJ的热量,利用物质的量与放出的热量成正比计算反应的二氧化硫,以此计算SO2的转化率;
(5)计算二氧化硫的含量,根据硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时不能任意排放来回答;
(6)2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1,该反应为放热反应,恒温、恒容,放出的能量以及转化率与参加反应的物质的物质的量成正比.
解答:
解:(1)SO2先与V2O5反应生成V2O4,V2O5参与反应作氧化剂,本身被还原为V2O4则二氧化硫被氧化为三氧化硫,
故答案为:SO2+V2O5?V2O4+SO3;
(2)2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,说明反应是气体体积减小的放热反应,则
A.c(SO2)=c(SO3)的状态,SO2和SO3浓度相等,无法判断正逆反应速率是否相等,故A错误;
B.混合气体质量不变,气体物质的量变化,当混合气体平均分子量保持不变的状态,说明反应达到平衡状态,故B正确;
C.单位时间生成2n mol的SO2同时生成n mol的O2的状态,是指反应逆向进行,不能说明费用达到平衡状态,故C错误;
D.V(SO2)正=2V(O2)逆的状态,说明压强正逆反应速率相同,证明反应达到平衡状态,故D正确;
故答案为:BD.
(3)当压强为0.1KPa时,SO2的转化率为0.90,SO2的转化率已很高,当压强为1.0KPa时,SO2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)设反应的二氧化硫为x,则
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
2mol 196.6kJ
x 353.6kJ
=
,解得x=3.6mol,
所以SO2的转化率为
×100%=90%,
故选:D;
(5)根据反应SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L
V(SO2)%=
×100%=0.1%,
故答案为:0.1%;
(6)在温度相同、体积均为1L的三个密闭容器中,SO3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO3)=1.4 mol?L-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO3)=1.4 mol.
甲 2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1.
起始量(mol) 2 1 0
变化量 (mol) 1.4 0.7 1.4 196.6kJ×
=137.62KJ
平衡量 (mol) 0.6 0.3
故a=137.62,α1=
=0.7,
乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=196.6kJ×(2-1.4)×
=58.98kJ.该反应从三氧化硫开始,α2=
=0.3,α1+α2=0.7+0.3=1.
丙 2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol) m n p
变化量 (mol) 0.2 0.1 1.4÷(1-12.5%)-1.4
平衡量 (mol) m+0.2 n+0.1 1.4
P=1.4÷(1-12.5%)=1.6,c=196.6kJ×(1.6-1.4)×
=19.66KJ
b+c=58.98KJ+19.66KJ=78.64kJ,
故答案为:1;1.6;78.64.
故答案为:SO2+V2O5?V2O4+SO3;
(2)2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1,说明反应是气体体积减小的放热反应,则
A.c(SO2)=c(SO3)的状态,SO2和SO3浓度相等,无法判断正逆反应速率是否相等,故A错误;
B.混合气体质量不变,气体物质的量变化,当混合气体平均分子量保持不变的状态,说明反应达到平衡状态,故B正确;
C.单位时间生成2n mol的SO2同时生成n mol的O2的状态,是指反应逆向进行,不能说明费用达到平衡状态,故C错误;
D.V(SO2)正=2V(O2)逆的状态,说明压强正逆反应速率相同,证明反应达到平衡状态,故D正确;
故答案为:BD.
(3)当压强为0.1KPa时,SO2的转化率为0.90,SO2的转化率已很高,当压强为1.0KPa时,SO2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)设反应的二氧化硫为x,则
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
2mol 196.6kJ
x 353.6kJ
| 2 |
| x |
| 196.6 |
| 353.6 |
所以SO2的转化率为
| 3.6 |
| 4 |
故选:D;
(5)根据反应SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L
V(SO2)%=
| 0.0112L |
| 11.2L |
故答案为:0.1%;
(6)在温度相同、体积均为1L的三个密闭容器中,SO3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO3)=1.4 mol?L-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO3)=1.4 mol.
甲 2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1.
起始量(mol) 2 1 0
变化量 (mol) 1.4 0.7 1.4 196.6kJ×
| 1.4 |
| 2 |
平衡量 (mol) 0.6 0.3
故a=137.62,α1=
| 1.4 |
| 2 |
乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=196.6kJ×(2-1.4)×
| 1 |
| 2 |
| 2-1.4 |
| 2 |
丙 2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol) m n p
变化量 (mol) 0.2 0.1 1.4÷(1-12.5%)-1.4
平衡量 (mol) m+0.2 n+0.1 1.4
P=1.4÷(1-12.5%)=1.6,c=196.6kJ×(1.6-1.4)×
| 1 |
| 2 |
b+c=58.98KJ+19.66KJ=78.64kJ,
故答案为:1;1.6;78.64.
点评:本题考查了硫酸的工业制取的生产原理应用.解题时需注意利用信息进行判断和书写化学方程式.该题还需掌握化学平衡的计算的基本方法,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式. Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.
Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表. 和
和
 和
和