题目内容
以物质的量为中心的计算
(1)NaOH的摩尔质量是 ,28g NaOH的物质的量是 .
(2)3.01×1023个O2的物质的量是 ,其实际质量是 g.
(3)标准状况下,67.2L HCl气体的物质的量是 ,把它溶解于水制成500mL盐酸溶液,该盐酸的物质的量浓度是 .
(1)NaOH的摩尔质量是
(2)3.01×1023个O2的物质的量是
(3)标准状况下,67.2L HCl气体的物质的量是
考点:物质的量的相关计算
专题:计算题
分析:(1)氢氧化钠的摩尔质量在数值上等于其相对分子质量,n=
;
(2)根据n=
、m=nM进行计算;
(3)根据n=
、C=
进行计算.
| m |
| M |
(2)根据n=
| N |
| NA |
(3)根据n=
| V |
| Vm |
| n |
| V |
解答:
解:(1)氢氧化钠的摩尔质量在数值上等于其相对分子质量,所以氢氧化钠的摩尔质量是40g/mol,n=
=
=0.7mol,
故答案为:40 g/mol;0.7 mol;
(2)n=
=
=0.5mol,m=nM=0.5mol×32g/mol=16g,
故答案为:0.5 mol;16;
(3)n=
=
=3mol,C=
=
=6mol/L,
故答案为:3 mol; 6 mol/L.
| m |
| M |
| 28g |
| 40g/mol |
故答案为:40 g/mol;0.7 mol;
(2)n=
| N |
| NA |
| 3.01×1023 |
| 6.02×1023/mol |
故答案为:0.5 mol;16;
(3)n=
| V |
| Vm |
| 67.2L |
| 22.4L/mol |
| n |
| V |
| 3mol |
| 0.5L |
故答案为:3 mol; 6 mol/L.
点评:本题考查了物质的量的有关计算,熟悉基本公式是解本题关键,根据公式中各个物理量的关系解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
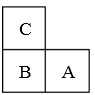 如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A
如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A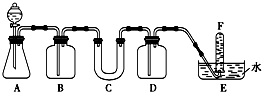 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.