题目内容
有A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数.C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个.试写出:
(1)A、C的元素符号分别为 、 .
(2)D原子的原子结构示意图为 ,B+的离子结构示意图 .
(1)A、C的元素符号分别为
(2)D原子的原子结构示意图为
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数,则A为S元素、B为K元素;C元素的原子只有1个电子,则C为H元素;A、D两元素原子核外电子总数比B元素原子质子数多9个,则D元素原子质子数=19+9-16=12,故D为Mg,据此解答.
解答:
解:A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数,则A为S元素、B为K元素;C元素的原子只有1个电子,则C为H元素;A、D两元素原子核外电子总数比B元素原子质子数多9个,则D元素原子质子数=19+9-16=12,故D为Mg,
(1)由上述分析可知,A为S元素、C为H元素,故答案为:S;H;
(2)D为Mg,原子结构示意图为: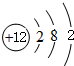 ;K+离子结构示意图为:
;K+离子结构示意图为: ,故答案为:
,故答案为: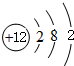 ;
; .
.
(1)由上述分析可知,A为S元素、C为H元素,故答案为:S;H;
(2)D为Mg,原子结构示意图为:
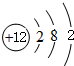 ;K+离子结构示意图为:
;K+离子结构示意图为: ,故答案为:
,故答案为: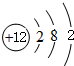 ;
; .
.
点评:本题考查原子结构及元素推断,比较基础,侧重对基础知识的巩固.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
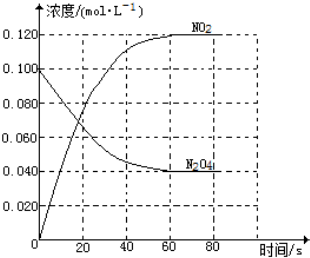 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.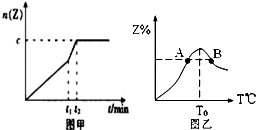 在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0
在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0 如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.
如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.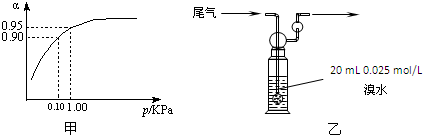
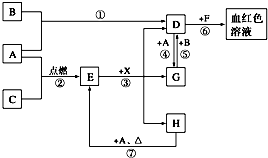 A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体.它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去).