题目内容
下列离子方程式书写不正确的是( )
| A、NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应:Cu2++S2-═CuS↓ |
| C、1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| D、Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.n(NaOH):n(SO2)=4:3时,反应生成亚硫酸根离子和亚硫酸氢根离子的混合物;
B.铜离子与硫离子反应生成 硫化铜沉淀,与反应物的量无关;
C.偏铝酸根离子与氢离子按照1:1反应生成氢氧化铝沉淀,按照1:4反应恰好生成铝离子,据此判断反应产物;
D.亚铁离子还原性大于溴离子,亚铁离子优先与氯气反应,然后溴离子与剩余氯气反应.
B.铜离子与硫离子反应生成 硫化铜沉淀,与反应物的量无关;
C.偏铝酸根离子与氢离子按照1:1反应生成氢氧化铝沉淀,按照1:4反应恰好生成铝离子,据此判断反应产物;
D.亚铁离子还原性大于溴离子,亚铁离子优先与氯气反应,然后溴离子与剩余氯气反应.
解答:
解:A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,假设有4mol氢氧化钠、3mol二氧化硫,4mol氢氧化钠与2mol二氧化硫反应SO32-,过量的1mol二氧化硫与SO32-反应生成2molHSO3-,反应后还剩余1molSO32-,反应的离子方程式为:4OH-+3SO2═SO32-+2HSO3-+H2O,故A正确;
B.CuCl2溶液与Na2S溶液2:1反应生成硫化铜沉淀,反应的离子方程式为:Cu2++S2-═CuS↓,故B正确;
C.1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合,偏铝酸钠与氯化氢的物质的量之比为2:5,2mol偏铝酸钠与2mol氯化氢反应生成2mol氢氧化铝,剩余的3mol氯化氢能够消耗1mol氢氧化铝,即反应后生成了等物质的量的氢氧化铝沉淀和铝离子,反应的离子方程式为:2AlO2-+5H+═Al(OH)3↓+Al3++H2O,故C正确;
D.当n(Cl2):n(FeBr2)=1:1时,1mol溴化亚铁中含有2mol溴离子、1mol亚铁离子,亚铁离子优先反应,1mol亚铁离子消耗0.5mol氯气,剩余的0.5mol氯气会消耗1mol溴离子,即溴离子有一半参与反应,正确的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D错误;
故选D.
B.CuCl2溶液与Na2S溶液2:1反应生成硫化铜沉淀,反应的离子方程式为:Cu2++S2-═CuS↓,故B正确;
C.1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合,偏铝酸钠与氯化氢的物质的量之比为2:5,2mol偏铝酸钠与2mol氯化氢反应生成2mol氢氧化铝,剩余的3mol氯化氢能够消耗1mol氢氧化铝,即反应后生成了等物质的量的氢氧化铝沉淀和铝离子,反应的离子方程式为:2AlO2-+5H+═Al(OH)3↓+Al3++H2O,故C正确;
D.当n(Cl2):n(FeBr2)=1:1时,1mol溴化亚铁中含有2mol溴离子、1mol亚铁离子,亚铁离子优先反应,1mol亚铁离子消耗0.5mol氯气,剩余的0.5mol氯气会消耗1mol溴离子,即溴离子有一半参与反应,正确的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D错误;
故选D.
点评:本题考查了离子方程式的正误判断,题目难度稍大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,本题侧重反应物过量情况的判断,根据反应物的量正确判断生成物是解答本题的关键.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
列关于①苯、②乙醇、③乙酸、④葡萄糖等有机物的叙述中,不正确的是( )
| A、可以用新制氢氧化铜鉴别③与④ |
| B、只有③能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、一定条件下,④可以转化为② |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是( )
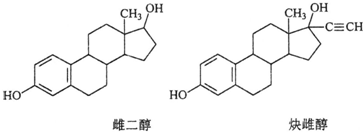

| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| B、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、向Ca(ClO)2溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
| D、FeSO4酸性溶液中加H2O2:2Fe2++H2O2═2Fe3++2OH- |
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、CO32- |
| B、K+、Fe2+、Cl-、NO3- |
| C、H+、Na+、SiO32-、CH3COO- |
| D、Ag+、K+、Br-、NO3- |
下列解释实验事实的化学方程式正确的是( )
A、5mol Fe和4mol Cl2反应:5Cl2+4Fe
| ||||
| B、2mol KMnO4和3mol H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+═Mn2++4O2↑+6H2O | ||||
| C、在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O | ||||
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- |
下列叙述不正确的是( )
| A、常温下,SO2、NO2、Cl2均为有刺激性气味、有毒的气体 |
| B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3?10H2O |
| C、人工合成的硅橡胶是目前最好的、既耐高温又耐低温的橡胶 |
| D、合金的硬度可以大于它的纯金属成分,合金的熔点也可以低于它的成分金属 |
