题目内容
13.已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子变成SO42-;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S的化合价是( )| A. | 2,+7 | B. | 2,+6 | C. | 4,+7 | D. | 4,+6 |
分析 Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,锰离子为还原剂;若反应后S2O8n-变成SO42-,S的化合价降低,SO42-中S的化合价为+6价,S2O8n-为氧化剂,然后根据原子守恒配平方程式,再根据电荷守恒判断n值,确定R的化合价.
解答 解:该反应中,Mn2+被氧化成MnO4-,锰元素的化合价变化为+2价→+7价,失电子化合价升高,Mn2+作还原剂;
反应后S2O8n-离子变成SO42-,氧元素的化合价不变,则R元素得电子化合价降低,R2O8n-作氧化剂,即R2O8n-与Mn2+的物质的量之比为5:2,根据各元素的原子守恒写出并配平该方程式为:8H2O+5R2O8n-+2Mn2+=2MnO4-+10RO42-+16H+,根据电荷守恒得:-5n+2×2=-1×2+(-2×10)+1×16,解得:n=2,
则S2O8n-离子为S2O82,R2O82-离子中R元素的化合价为+7价,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
3.将1.92g铜粉与足量硝酸反应,收集到1.12L(标况)气体,则消耗的硝酸的物质的量是( )
| A. | 0.09mol | B. | 0.11mol | C. | 0.12mol | D. | 0.2mol |
4.下列离子方程式中,能正确表示盐的水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| C. | S2-+2H2O═H2S+2OH- | D. | Br-+H2O═HBr+OH- |
1.对于A2(g)+3B2(g)═2C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
8.向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大下列对应关系正确的是( )
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D | 0.03 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法不正确的是( )
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
2.下列关于同系物和同分异构体的说法正确的是( )
| A. | 甘氨酸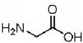 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 | |
| B. | 具有相同通式的两种有机物,要么互为同系物要么互为同分异构体 | |
| C. | C3H9N有四种 | |
| D. | 有机物中碳原子数一定时,烷烃中氢原子数最多 |
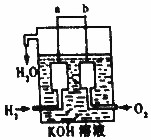 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题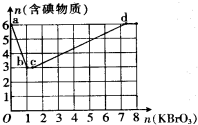 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应: