题目内容
8.已知在碱性条件下,氯气会发生自身氧化-还原反应,某条件下,反应体系的物质为:KClO3、Cl2、KCl、KOH、H2O.(1)在该反应中KClO3是氧化产物(填“氧化剂”、“还原剂”或“氧化产物”、“还原产物”).
(2)请把反应物的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:3Cl2+6KOH+□→□
(3)若反应中有1mol电子发生转移,则参加反应的KOH 是1.2mol
(4)实验室利用6HCl+KClO3→KCl+3H2O+3Cl2↑ 可制取Cl2.根据该反应可推知D
A.KCl是还原产物 B.盐酸在反应中仅仅是还原剂
C.反应中转移的电子数为6e D.从方程式可知还原性:HCl>Cl2.
分析 (1)生成KClO3时,Cl元素的化合价由0升高为+5价,化合价升高时生成氧化产物;
(2)根据电子守恒来配平化学方程式,并根据化合价的升降来标出电子转移情况;
(3)据化学方程式分析;
(4)KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3H2O+3Cl2↑中,Cl元素的化合价由+5价 降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:(1)氯气生成KClO3,Cl元素化合价升高生成氧化产物,故答案为:氧化产物;
(2)氯气与KOH反应生成KCl和KClO3,据电子守恒写出化学方程式为3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,每生成5molKCl同时生成1molKClO3转移5mol电子,
故答案为:3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;5mol;
(3)氯气与KOH反应的化学方程式为化学方程式为3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O,每生成5molKCl和1molKClO3转移5mol电子,同时消耗6molKOH,若反应中有1mol电子发生转移,则参加反应的KOH 是$\frac{6}{5}$mol=1.2mol,故答案为:1.2mol;
(4)A、KCl中Cl元素化合价在反应前后没有变化,故A错误;
B、HCl在反应中即是还原剂同时也表现了酸性,因为生成KCl,故B错误;
C、Cl元素的化合价由+5价 降低为0,Cl元素的化合价由-1价升高为0,反应中转移的电子数为5,故C错误;
D、HCl是还原剂,氯气是还原产物,所以还原性:HCl>Cl2,故D正确;
故答案为:D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念及转移电子计算,题目难度不大.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案| A. | 6 | B. | 12 | C. | 18 | D. | 24 |
| A. | HCl | B. | N2 | C. | AlCl3 | D. | NH4Cl |

| A. | SiO2 | B. | CO2 | C. | Na | D. | HNO3 |
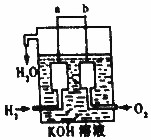 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题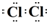 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.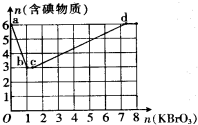 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应: