题目内容
14.已知A、B、C、D、G为中学化学中常见的物质,其中A为单质,B、C、D、G均为化合物.它们之间存在以下的相互转化关系:
试回答:
(1)写出A的化学式Fe;
(2)写出由E转变成F的化学方程式:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)向G溶液加入A的有关离子方程式:2Fe3++Fe=3Fe2+;
(4)检验B溶液中的阳离子的化学方法:在试管中取少量B溶液,滴加KSCN溶液,溶液不变红色,再滴加Cl2水(或H2O2溶液),溶液变红色,则含有Fe2+,反之则无.
分析 由反应E→F的现象可知A为Fe,与盐酸反应生成的气体为H2,B为FeCl2,加入C生成沉淀,C应为碱,且D焰色反应呈黄色,可知C为NaOH,D为NaCl,E为FeCl2,F为Fe(OH)3,G为FeCl3,以此解答该题.
解答 解:由反应E→F的现象可知A为Fe,与盐酸反应生成的气体为H2,B为FeCl2,加入C生成沉淀,C应为碱,且D焰色反应呈黄色,可知C为NaOH,D为NaCl,E为FeCl2,F为Fe(OH)3,G为FeCl3,
(1)由以上分析可知A为Fe,故答案为:Fe;
(2)由E转变成F的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)G为FeCl3,A为Fe,向G溶液加入A,发生2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
(4)B为FeCl2,检验B溶液中的阳离子的化学方法是在试管中取少量B溶液,滴加KSCN溶液,溶液不变红色,再滴加Cl2水(或H2O2溶液),溶液变红色,则含有Fe2+,反之则无,
故答案为:在试管中取少量B溶液,滴加KSCN溶液,溶液不变红色,再滴加Cl2水(或H2O2溶液),溶液变红色,则含有Fe2+,反之则无.
点评 本题是考查物质推断与性质、常用化学用语,为高频考点,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列离子方程式中,能正确表示盐的水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| C. | S2-+2H2O═H2S+2OH- | D. | Br-+H2O═HBr+OH- |
5.下列说法不正确的是( )
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
2.下列关于同系物和同分异构体的说法正确的是( )
| A. | 甘氨酸 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 和硝基丙烷 CH3CH2CH2NO2互为同分异构体 | |
| B. | 具有相同通式的两种有机物,要么互为同系物要么互为同分异构体 | |
| C. | C3H9N有四种 | |
| D. | 有机物中碳原子数一定时,烷烃中氢原子数最多 |
9.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)SO2与过量NaOH溶液反应后的产物化学式Na2SO3.
(2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为Cl2+SO32-+2OH-═2Cl-+SO42-+H2O.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:只有ClO-.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L-1H2SO4、1moL•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
18.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L SO3含有NA个分子 | |
| B. | 过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2 NA | |
| C. | 6.4 g氧气和3.2 g臭氧(O3)混合气体所含有的氧原子数为0.6 NA | |
| D. | 标准状况下,2.24 L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1 NA |
 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.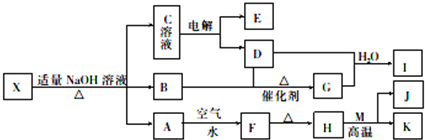
 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应: