题目内容
16.高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%.回答下列问题:(1)上述提及的气体分子中,电子数相等的两种气体是N2、CO(写化学式).
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+$\frac{1}{2}$O2(g)△H=+35.7kJ/mol.
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离.
①工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式CH3COOCu(NH3)2(aq)+CO(g)═CH3COOCu(NH3)2•CO(aq)△H<0.吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有升温或减压(写出一种即可).
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图是变压吸附回收高炉煤气中CO的流程图:

PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2脱除(保证PSA-I吸附CO2的时间),“放空气体”的主要成分为氮气.

(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g).该反应在不同温度下的平衡常数如表所示:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
②欲提高上述反应中CO 的转化率,可采取的措施是ab.
a.适当降低反应体系的温度
b.及时移出体系中的CO
c.加入合适的催化剂
d.减小容器的容积
e.增大Fe2O3的量.
分析 (1)N2、CO、CO2、H2O中的电子数分别为14、14、22和10个;
(2)根据盖斯定律来分析;
(3)①吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,平衡逆向进行,结合平衡移动原理分析;
②CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高;
(4)①温度越高,该反应的平衡常数越小;
②a.适当降低反应体系的温度,平衡右移;
b.及时移出体系中的CO2,平衡右移;
c.加入合适的催化剂,平衡不移动;
d.减小容器的容积,平衡不移动;
e.增大Fe2O3的量,平衡不移动.
解答 解:(1)N2、CO、CO2、H2O中的电子数分别为14、14、22和10个,故氮气和CO为等电子体,故答案为:N2、CO;
(2)已知反应①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol
根据盖斯定律可知,将①×2+②-③可得:CO(g)+2H2(g)=CH4(g)+$\frac{1}{2}$O2(g)△H=(-285.8kJ/mol)×2+(-283.0kJ/mol)-(-890.3kJ/mol)=+35.7KJ/mol,故答案为:+35.7;
(3)①CH3COOCu(NH3)2 (aq)+CO(g)?CH3COOCu(NH3)2•CO(aq)△H<0,反应是气体体积减小的放热反应,故升高温度或减小压强均可以使平衡左移从而实现CO与吸收液的分离,故答案为:升温或减压;
②CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高,为了保证载铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间);放空气体”的主要成分为氮气.
故答案为:尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间);氮气;
(4)①温度越高,该反应的平衡常数越小,故升高温度,平衡左移,则反应放热,即△H小于0,故答案为:<;
②a.适当降低反应体系的温度,平衡右移,则CO的平衡转化率提高,故a正确;
b.及时移出体系中的CO2,平衡右移,则CO的平衡转化率提高,故b正确;
c.加入合适的催化剂,平衡不移动,CO的平衡转化率不变,故c错误;
d.由于此反应是个气体的物质的量不变的反应,故减小容器的容积,平衡不移动,CO的平衡转化率不变,故d错误;
e.由于氧化铁为固体,故增大Fe2O3的量,平衡不移动,则CO的平衡转化率不变,故e错误.
故选ab.
点评 本题考查了平衡的移动和盖斯定律的有关应用,综合性较强,难度适中,应注意的是催化剂只能加快反应速率,不能使平衡发生移动,故不能提高物质的转化率.

| A. | NH4+、OH-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、Cl-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
| A. | 放电时,负极反应为:Zn+4OH--2e-=Zn(OH)42- | |
| B. | 充电时,电解质溶液中K+向阳极移动 | |
| C. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
| A. | 在沸水中滴入含0.1molFeC13的饱和溶液,制得胶粒数为0.1 NA | |
| B. | 含0.4mol HNO3的稀硝酸与足量Fe反应,转移电子数为1.2 NA | |
| C. | 120 gNaHSO4和MgSO4的晶体混合物中阳离子数为NA | |
| D. | 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2NA |
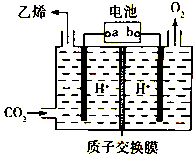 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
| A. | 以Na2O2作供氧剂时,发生了氧化还原反应 | |
| B. | 在食品袋中放人CaCl2•6H2O,可防止食物受潮 | |
| C. | 人工合成食品级酯可以用作糖果的香料 | |
| D. | 用NH4Cl浓溶液除铁锈,因为NH4 Cl水解显酸性 |
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol/L | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol/L | D. | 溶液中c(Ag+)≈3.2×10-8mol/L |
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |