题目内容
4.常温下,pH=2的二元弱酸H2R溶液与pH=12的NaOH溶液混合后,混合液的pH=7,下列判断正确的是.| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
分析 常温下,pH=2的二元弱酸H2R溶液中酸的物质的量浓度大于0.01mol/L,pH=12的NaOH溶液中氢氧化钠的物质的量浓度是0.01mol/L,混合溶液呈中性,说明溶液中c(OH-)=c(H+),根据电荷守恒和物料守恒分析解答.
解答 解:A.H2R+2NaOH═Na2R+2H2O,由于H2R是弱酸,浓度必大于10-2mol•L-1,所以两者反应呈中性时,消耗的H2R的体积不需要V L,故A错误;
B.溶液中存在电荷守恒(Na+)+c(H+)=c(OH-)+2(R2-)+c(HR-),故B错误;
C.混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒知,(Na+)+c(H+)=c(OH-)+2(R2-)+c(HR-),所以2c(R2-)+c(HR-)=c(Na+),故C正确;
D.混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒知,(Na+)+c(H+)=c(OH-)+2(R2-)+c(HR-),则(Na+)>c(HR-),故D错误;
故选C.
点评 本题考查了离子浓度大小的比较,根据电荷守恒结合溶液的酸碱性来分析解答即可,难度中等.

练习册系列答案
相关题目
19.阿伏加德罗常数为 NA,下列说法正确的是( )
| A. | 1 mol 钠与氧气反应生成 Na2O 或 Na2O2时,失电子数目均为 NA | |
| B. | 1 mol/L 的 NaOH 溶液中含 Na+数目为 NA | |
| C. | 标准状况下,2.24LC6H6 所含的分子数目为 0.1NA | |
| D. | 1 mol Na2O2 中含有的阴离子数目为 2NA |
9.在反应X+2Y=R+2M 中,已知R和M的摩尔质量之比为22:9,当1.6g的X与Y完全反应后,生成4.4g的R,则此反应中Y和M的质量之比为( )
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
16.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出5m3CO2 |
13.保存下列物质的方法正确是( )
| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
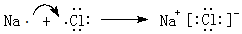 .
. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.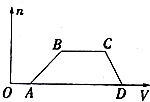 某混合溶液中可能含有H2SO4、MgCl2、Al2(SO4)3、NH4Cl、NaCl中的几种物质,往该溶液中逐渐加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题:
某混合溶液中可能含有H2SO4、MgCl2、Al2(SO4)3、NH4Cl、NaCl中的几种物质,往该溶液中逐渐加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题: