题目内容
9.在反应X+2Y=R+2M 中,已知R和M的摩尔质量之比为22:9,当1.6g的X与Y完全反应后,生成4.4g的R,则此反应中Y和M的质量之比为( )| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
分析 首先根据化学方程式和已知条件“R和M的相对分子质量之比为22:9”以及R的质量,列出比例式,即可求出M的质量;
然后根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,则Y的质量=R的质量+M的质量-X的质量;然后写出两者的比,据此选择即可.
解答 解:根据已知条件“R和M的相对分子质量之比为22:9”,则R:2M=22:2×9=22:18,
设生成的M的质量为a,则22:18=4.4g:a,解之得:a=3.6g;
再根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g;
所以此反应中Y和M的质量比是6.4g:3.6g=16:9,
故选:A.
点评 本题主要考查学生运用化学方程式和质量守恒定律解答实际问题的能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
20.为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
根据以上表格内容回答:
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
17.下列各组离子在水溶液中一定能大量共存的是( )
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
4.常温下,pH=2的二元弱酸H2R溶液与pH=12的NaOH溶液混合后,混合液的pH=7,下列判断正确的是.
| A. | 两溶液一定是等体积混合 | B. | 溶液中:c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+) | ||
| C. | 溶液中2c(R2-)+c(HR-)=c(Na+) | D. | 溶液中:c(HR-)>c(Na+)>c(H+)=c(OH-) |
14.实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液l00g,需要20%的NaOH溶液( )
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
1.以下是元素周期表的一部分,回答下列有关问题:
(1)与水反应最剧烈的金属元素是K;元素构成的最稳定气态氢化物的化学式是HF;③、④、⑧元素原子半径由大到小是Si>N>O(用元素符号作答).
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为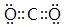 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程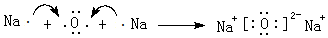 .
.
(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为
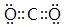 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程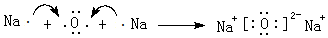 .
.(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
18.下列说法中正确的是( )
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
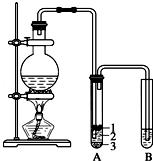 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
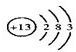 ; F的化学式FeCl2.
; F的化学式FeCl2.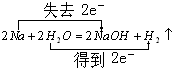 .反应②:
.反应②: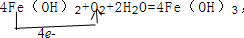 .
.