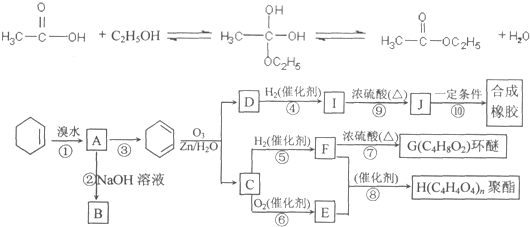
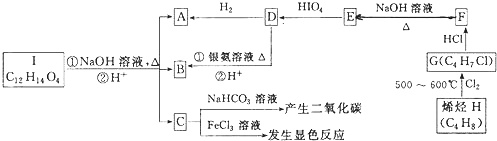
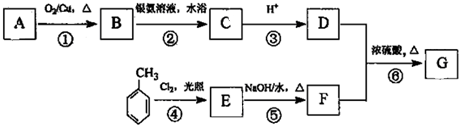
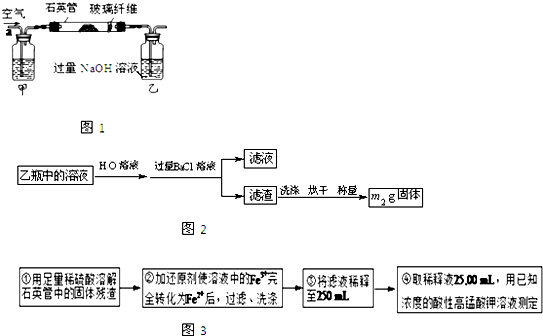
题目内容
下列说法正确的是( )
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、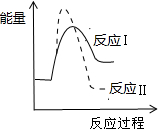 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A.催化剂只降低活化能,不改变反应热;
B.C完全燃烧放出的热量较多,放热反应的△H为负值;
C.△H=正反应的活化能-逆反应的活化能;
D.反应的活化能越低反应速率越大.
B.C完全燃烧放出的热量较多,放热反应的△H为负值;
C.△H=正反应的活化能-逆反应的活化能;
D.反应的活化能越低反应速率越大.
解答:
解:A.催化剂只降低活化能,不改变反应热,加入催化剂,放出的热量不变,故A错误;
B.C完全燃烧放出的热量较多,放热反应的△H为负值,已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2;故B错误;
C.△H=正反应的活化能-逆反应的活化能,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol,故C正确;
D.由图可知,反应Ⅰ中反应物的总能量小于生成物的总能量是吸热反应,反应Ⅱ中反应物的总能量大于生成物的总能量是放热反应,反应I中的活化能小,则反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),故D错误.
故选C.
B.C完全燃烧放出的热量较多,放热反应的△H为负值,已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2;故B错误;
C.△H=正反应的活化能-逆反应的活化能,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol,故C正确;
D.由图可知,反应Ⅰ中反应物的总能量小于生成物的总能量是吸热反应,反应Ⅱ中反应物的总能量大于生成物的总能量是放热反应,反应I中的活化能小,则反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),故D错误.
故选C.
点评:本题考查了化学反应中的能量变化,侧重于基础知识的考查,题目难度不大,注意把握催化剂对化学平衡和反应热的影响.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ/mol
下列说法错误的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+
| 1 |
| 2 |
下列说法错误的是( )
| A、1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ | ||
B、根据反应①和②推知反应:H2(g)+
| ||
| C、CH3OH转变成H2的过程不一定要吸收能量 | ||
D、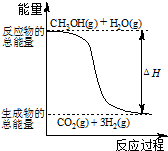 反应①中的能量变化如图所示 |
某胶体遇盐卤(MgCl2 )或石膏水发生凝聚,而遇食盐水或Na2SO4 溶液不易发生凝聚,下列说法中错误的是( )
| A、胶体粒子直径在lnm~100nm |
| B、遇BaCl2溶液或Fe(OH)3胶体可发生聚沉 |
| C、电泳时,该胶体向阴极方向移动 |
| D、Na+使此胶体凝聚的效果不如Ca2+、Mg2+ |