题目内容
乙烯(CH2=CH2)是一种重要的基本化工原料.请回答下列问题:
(1)CH2=CH2分子属于 (填“极性”或“非极性”)分子.
(2)1个CH2=CH2分子中含有 个σ键, 个π键.
(3)CH2=CH2分子中C原子的杂化轨道类型是 .
(1)CH2=CH2分子属于
(2)1个CH2=CH2分子中含有
(3)CH2=CH2分子中C原子的杂化轨道类型是
考点:化学键,乙烯的化学性质
专题:有机反应
分析:(1)双键为平面结构,且乙烯结构对称;
(2)双键中1个为σ键,1个为π键,而C-H键为σ键;
(3)CH2=CH2分子中C原子上没有孤对电子,σ键数为3,以此来解答.
(2)双键中1个为σ键,1个为π键,而C-H键为σ键;
(3)CH2=CH2分子中C原子上没有孤对电子,σ键数为3,以此来解答.
解答:
解:(1)双键为平面结构,且乙烯结构对称,则正负电荷的中心重合,为非极性分子,故答案为:非极性;
(2)双键中1个为σ键,1个为π键,而C-H键为σ键,则1个分子中含5个σ键,1个π键,故答案为:5;1;
(3)乙烯分子每个碳原子含有3个σ 键且不含孤电子对,所以采取sp2杂化,故答案为:sp2.
(2)双键中1个为σ键,1个为π键,而C-H键为σ键,则1个分子中含5个σ键,1个π键,故答案为:5;1;
(3)乙烯分子每个碳原子含有3个σ 键且不含孤电子对,所以采取sp2杂化,故答案为:sp2.
点评:本题考查化学键及共价键的类型,为高频考点,把握乙烯中含双键及单键的数目为解答的关键,注重分子结构与性质的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、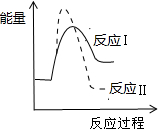 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |
已知复印机工作时易产生臭氧,臭氧浓度过高时对人体有害,臭氧具有强氧化性,可以使湿润碘化钾淀粉试纸变蓝,其中臭氧部分转化成氧气,关于该反应的说法正确的是( )
| A、该反应的离子方程式为:2I-+O3+H2O═2OH-+I2+O2 |
| B、反应中每1mol臭氧参加反应电子转移数为6mol |
| C、O2是该反应的还原产物 |
| D、由该反应可知氧化性的大小顺序:O3>O2 |


 )
)

 的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH
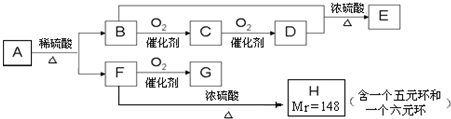
 是我国特产漆的主要成分.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是
是我国特产漆的主要成分.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是