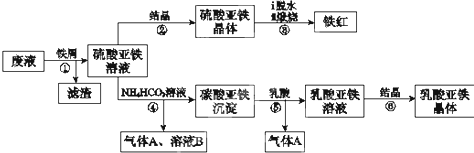
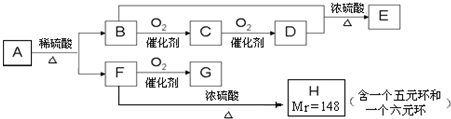
题目内容
黄铁矿(主要成分为FeS2)是一种十分重要的矿物,曾是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对黄铁矿石进行如下实验探究.
【实验一】测定硫元素的含量.
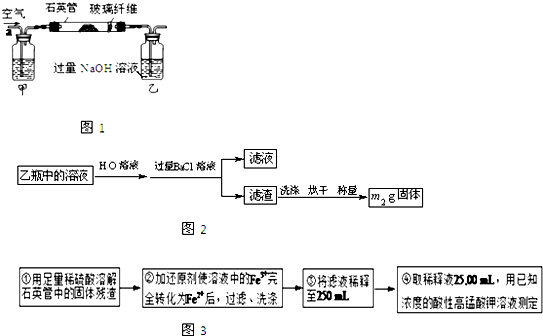
Ⅰ.将m1 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:
4FeS2+11O2
2Fe2O3+8SO2
Ⅱ.反应结束后,将乙瓶中的溶液进行如图2所示处理.(提示:H2O2可以氧化亚硫酸钠溶液)
【实验二】测定铁元素的含量.
Ⅲ.测定铁元素的含量的实验步骤如图3所示.MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
问题讨论:
(1)上述装置中,仅考虑硫元素含量测定准确性,甲瓶内所盛试剂是 溶液.
(2)II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号).
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 .
(4)写出用稀硫酸溶解石英管中固体物的主要反应的离子方程式 .
III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由.
(填“合理“或”不合理“)、理由: (如合理,则此空不填).
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 .

【实验一】测定硫元素的含量.
Ⅰ.将m1 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:
4FeS2+11O2
| ||
Ⅱ.反应结束后,将乙瓶中的溶液进行如图2所示处理.(提示:H2O2可以氧化亚硫酸钠溶液)
【实验二】测定铁元素的含量.
Ⅲ.测定铁元素的含量的实验步骤如图3所示.MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
问题讨论:
(1)上述装置中,仅考虑硫元素含量测定准确性,甲瓶内所盛试剂是
(2)II中除了可以用H2O2溶液作为氧化剂,还可以加入
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为
(4)写出用稀硫酸溶解石英管中固体物的主要反应的离子方程式
III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由.
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有
考点:探究物质的组成或测量物质的含量,含硫物质的性质及综合应用
专题:实验探究和数据处理题
分析:(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉;二氧化硫能和氢氧化钠反应生成盐;亚硫酸根离子能被氧气氧化生成硫酸根离子;
(2)双氧水足量时才能将亚硫酸根离子完全转化,氯水、硝酸、硫酸铁都可以氧化亚硫酸钠,浓硫酸不能氧化亚硫酸钠;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)稀硫酸溶解石英管中固体物的主要反应是硫酸和氧化铁的反应生成硫酸铁和水,铁能转化为亚铁离子导致铁的含量增大;
(5)测定铁元素的含量需要测定消耗高锰酸钾溶液的体积;
(2)双氧水足量时才能将亚硫酸根离子完全转化,氯水、硝酸、硫酸铁都可以氧化亚硫酸钠,浓硫酸不能氧化亚硫酸钠;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)稀硫酸溶解石英管中固体物的主要反应是硫酸和氧化铁的反应生成硫酸铁和水,铁能转化为亚铁离子导致铁的含量增大;
(5)测定铁元素的含量需要测定消耗高锰酸钾溶液的体积;
解答:
解:(1)甲瓶是利用氢氧化钠溶液吸收空气中的二氧化碳,提供氧气氧化硫铁矿,避免二氧化碳干扰乙装置对二氧化硫的定量测定;
故答案为:NaOH;
(2)分析流程可知加入过氧化氢把亚硫酸钠氧化为硫酸钠,且不引入杂质,使SO32-完全氧化为SO42-,氯水、硝酸、硫酸铁都可以氧化亚硫酸钠,但增加铁离子,浓硫酸不能氧化亚硫酸钠;
故答案:①③;
(3)将m1 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,生成的二氧化硫被过量氢氧化钠吸收生成亚硫酸钠,部分被氧化为硫酸钠,加入过氧化氢把亚硫酸钠全部氧化为硫酸钠,加入过量绿化比溶液得到沉淀质量为m2g为硫酸钡的质量,物质的量=
mol;
则黄铁矿中硫元素的质量分数=
×100%=
×100%;
故答案为:
×100%;
(4)稀硫酸溶解石英管中固体物的主要反应是硫酸和氧化铁的反应,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,若选用铁粉作还原剂,加入铁元素,被高锰酸钾溶液滴定的亚铁离子增大,无法测定铁元素的含量,测定铁元素的含量增大;
故答案为:Fe2O3+6H+=2Fe3++3H2O,不合理,加入铁元素,无法测定铁元素的含量;
(5)测定铁元素的含量需要测定消耗高锰酸钾溶液的体积,结合离子反应定量关系计算;
故答案为:消耗高锰酸钾溶液的体积;
故答案为:NaOH;
(2)分析流程可知加入过氧化氢把亚硫酸钠氧化为硫酸钠,且不引入杂质,使SO32-完全氧化为SO42-,氯水、硝酸、硫酸铁都可以氧化亚硫酸钠,但增加铁离子,浓硫酸不能氧化亚硫酸钠;
故答案:①③;
(3)将m1 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,生成的二氧化硫被过量氢氧化钠吸收生成亚硫酸钠,部分被氧化为硫酸钠,加入过氧化氢把亚硫酸钠全部氧化为硫酸钠,加入过量绿化比溶液得到沉淀质量为m2g为硫酸钡的质量,物质的量=
| m2 |
| 233 |
则黄铁矿中硫元素的质量分数=
| ||
| m1 |
| 32m2 |
| 233m1 |
故答案为:
| 32m2 |
| 233m1 |
(4)稀硫酸溶解石英管中固体物的主要反应是硫酸和氧化铁的反应,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,若选用铁粉作还原剂,加入铁元素,被高锰酸钾溶液滴定的亚铁离子增大,无法测定铁元素的含量,测定铁元素的含量增大;
故答案为:Fe2O3+6H+=2Fe3++3H2O,不合理,加入铁元素,无法测定铁元素的含量;
(5)测定铁元素的含量需要测定消耗高锰酸钾溶液的体积,结合离子反应定量关系计算;
故答案为:消耗高锰酸钾溶液的体积;
点评:本题考查了物质性质的实验验证和流程分析判断,物质性质和干信息的利用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、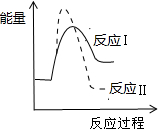 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |
乙醇可以发生下列反应,在反应中乙醇分子断裂C-O键而失去羟基的是( )
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、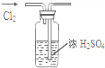 干燥Cl2 干燥Cl2 |
B、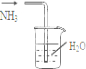 吸收NH3 |
C、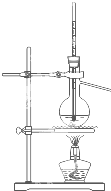 制取蒸馏水 |
D、 吸收SO2 吸收SO2 |