题目内容
3.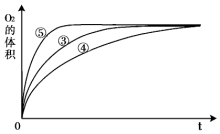 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)写出实验③的化学反应方程式2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$O2↑+2H2O.
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析上图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析 (1)根据实验①和②的浓度不同分析;
(2)氯化铁为催化剂,双氧水在催化剂作用下分解生成水和氧气;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答 解:(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,
故答案为:探究浓度对反应速率的影响;
(2)常温下5% H2O2在FeCl3溶液的催化作用下发生反应生成水和氧气,反应的化学方程式为:2H2O2 $\frac{\underline{\;FeCl_{3}\;}}{\;}$O2↑+2H2O,
故答案为:2H2O2 $\frac{\underline{\;FeCl_{3}\;}}{\;}$O2↑+2H2O;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,③的反应速率居中,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查影响化学反应速率的因素,题目难度中等,明确化学反应速率的影响因素为解答关键,试题侧重考查学生实验设计、数据处理、图象分析的综合能力.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
5.下列说法正确的是( )
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 金属钠、镁着火时可用泡沫灭火器扑灭 | |
| C. | 用玻璃棒蘸取待测液于湿润的pH试纸上测pH 值 | |
| D. | 常温下1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
6.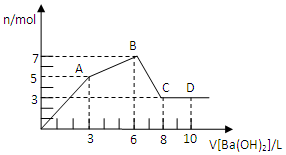 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是[Al(OH)4]- | |
| B. | 向D点溶液中通入过量CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2Al(OH)4-+3BaSO4↓ |
11.甲醛(CH2O)的水溶液叫做“福尔马林”,常用来保存动物标本.下列关于甲醛的叙述中,不正确的是( )
| A. | 一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的 | |
| B. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 | |
| C. | 甲醛由碳、氢、氧三种元素组成的 | |
| D. | 甲醛中氧元素的质量分数为53.3% |
18.在同温、同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2 (g)△H1 S(s)+O2(g)═SO2 (g)△H2 | |
| C. | C(s)+O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | HCl(g)═H2(g)+Cl2(g)△H1 2HCl(g)═H2(g)+Cl2(g)△H2 |
8.已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
15.根据下列实验操作和现象所得出的结论错误的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | SO2通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | SO2具有还原性 |
| B | 向NaSiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| C | 将盛有铜片的容器中加入浓硝酸 | 产生大量红棕色气体;溶液变为蓝绿色 | 浓硝酸具有强氧化性 |
| D | 浓硫酸滴到湿润的蔗糖中 | 蔗糖变成黑色海绵状 | 浓硫酸具有脱水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
12.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量待检验溶液,向其中加入少量新制氯水,在滴加KSCN溶液,溶液呈血红色 | 待测液中含有Fe3+ |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2SO4)<Ksp(Ca2SO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5 | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |