题目内容
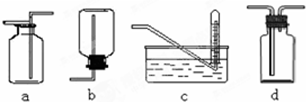
19.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.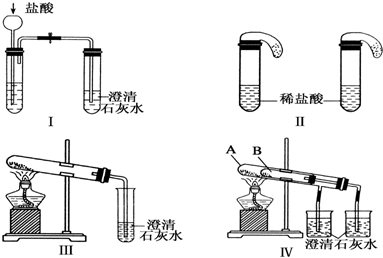
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)Ⅱ;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O;与实验Ⅲ相比,实验Ⅳ的优点是操作简便;
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是NaHCO3;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.
①当石灰水过量时,其离子方程式为Ca2++OH-+HCO3-═CaCO3↓+H2O;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为Na2CO3.
(5)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出另外两种不同的鉴别方法.
①焰色反应,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3.
②加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3.
分析 (1)I中石灰水均变浑浊,而Ⅱ中气球的大小不同;
(2)碳酸氢钠加热分解,而碳酸钠不能,实验Ⅲ操作简单,对比性强;
(3)用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,大试管中为碳酸钠,温度高不分解,具有对比性;
(4)①当石灰水过量时,碳酸氢钠完全反应,生成碳酸钙、NaOH和水;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,生成碳酸钠、碳酸钙和水;
(5)K2CO3和NaHCO3中阳离子不同,且阴离子可利用氯化钡或氯化钙检验,以此来解答.
解答 解:(1)I中石灰水均变浑浊,而相同条件下Ⅱ中气球的大小不同,则鉴别二者能够达到实验目的是Ⅱ,故答案为:Ⅱ;
(2)碳酸氢钠加热分解,而碳酸钠不能,发生的反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,与实验Ⅲ相比,实验Ⅳ的优点是操作简便,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;CO2+Ca(OH)2═CaCO3↓+H2O;操作简便;
(3)用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是NaHCO3,温度低分解,具有对比性,故答案为:NaHCO3;
(4)①当石灰水过量时,碳酸氢钠完全反应,生成碳酸钙、NaOH和水,离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故答案为:Ca2++OH-+HCO3-═CaCO3↓+H2O;
②所得溶液中溶质的化学式为Na2CO3,故答案为:Na2CO3;
(5)K2CO3和NaHCO3中阳离子不同,且阴离子可利用氯化钡或氯化钙检验,检验方法为①焰色反应,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3;②加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3,
故答案为:焰色反应,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3;加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是NaHCO3.
点评 本题考查性质实验方案的设计,涉及物质的鉴别和检验及实验技能,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意常见离子的检验方法及实验设计能力,题目难度不大.

| A. | NH3的结构式为: | B. | NH4Cl的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | -CH3(甲基)的电子式为: |
请回答下列问题:
(1)生石灰加入沸水中,写出该化学反应的化学方程式CaO+H2O=Ca(OH)2,水能持续保持沸腾,其原因是反应过程放热.
(2)静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为红色.
(3)取上层清液分析,一定含有的溶质NaOH、NaCl.可能还含有其它溶质,但不可能Ca(OH)2与Na2CO3同时存在,理由是Ca(OH)2+Na2CO3=2NaOH+CaCO3↓(用化学方程式表示).
(4)你认为可能含有的溶质Na2CO3或Ca(OH)2,并用实验证明.
| 实验步骤 | 实验现象 |
(6)在上述反应过程中,没有涉及到的化学反应类型分解反应、置换反应.
| A. | 苯的分子式为C6H6 | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 四氯化碳的电子式: | D. | 硫离子结构示意图: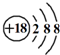 |
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 乙醇 |
 前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.
前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.
 .
. .
.