题目内容
14.短周期主族元素W、X、Y、Z的原子序数依次增大.W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半.下列叙述正确的是( )| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
分析 短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,设W、Z的最外层电子数为x,则Y的为x-1,2x+x-1=11,x=4,可知W为C元素,Y为Al,Z为Si元素,X原子最外层电子数等于最内层电子数的一半,由原子序数关系可知应为Na元素,以此解答该题.
解答 解:短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,设W、Z的最外层电子数为x,则Y的为x-1,2x+x-1=11,x=4,可知W为C元素,Y为Al,Z为Si元素,X原子最外层电子数等于最内层电子数的一半,由原子序数关系可知应为Na元素,
A.同周期元素从左到右金属性逐渐减弱,则金属性:X>Y,故A错误;
B.同周期元素从左到右原子半径逐渐减小,故B正确;
C.非金属性C>Si,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.氢氧化铝为两性氢氧化物,可与氢氧化钠溶液反应,故D错误.
故选B.
点评 本题考查结构性质位置关系综合应用,为高频考点,侧重对元素周期律的考查,关键是计算确定元素种类,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
5.下列离子或分子组中,在相应的环境中一定能大量共存的是( )
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
2.常温下,下列溶液中各组离子一定能够大量共存的是( )
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
9.短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X原子核外M电子层的电子数为1,Y是地壳中含量最高的金属元素,Z的单质可用于自来水的杀菌消毒.根据以上叙述,下列说法中正确的是( )
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
6.Li-Al/FeS电池是一种正在开发的车载锂电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe有关该电池的下列说法中,正确的是( )
| A. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| B. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| C. | 负极的电极反应式为Al-3e-═Al3+ | |
| D. | 电解质溶液可以是氢氧化钠溶液或者稀硫酸 |
3.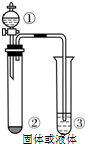 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )| 选项 | ① | ② | ③ | 实验目的或结论 |
| A | 浓氨水 | 生石灰 | 水 | 制取氨气并吸收尾气 |
| B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| C | 浓磷酸 | 氢溴酸溶液 | AgCl的浊液 | 验证Ksp(AgCl)>Ksp(AgBr) |
| D | 浓硫酸 | 亚硫酸钠 | 高锰酸钾溶液 | 验证二氧化硫的漂白性 |
| A. | A | B. | B | C. | C | D. | D |

 ;
;