题目内容
3. 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )| 选项 | ① | ② | ③ | 实验目的或结论 |
| A | 浓氨水 | 生石灰 | 水 | 制取氨气并吸收尾气 |
| B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| C | 浓磷酸 | 氢溴酸溶液 | AgCl的浊液 | 验证Ksp(AgCl)>Ksp(AgBr) |
| D | 浓硫酸 | 亚硫酸钠 | 高锰酸钾溶液 | 验证二氧化硫的漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气极易溶于水;
B.浓盐酸和二氧化锰需要加热才能反应;
C.氢溴酸易挥发,沉淀向更难溶的方向转化;
D.二氧化硫有还原性.
解答 解:A.氨气极易溶于水,缺少防倒吸装置,故A错误;
B.浓盐酸和二氧化锰需要加热才能反应,缺少加热装置,故B错误;
C.氢溴酸易挥发,沉淀向更难溶的方向转化,白色沉淀变为淡黄色,可验证Ksp(AgCl)>Ksp(AgBr),故C正确;
D.二氧化硫有还原性,能使高锰酸钾溶液褪色,故D错误.
故选C.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.短周期主族元素W、X、Y、Z的原子序数依次增大.W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半.下列叙述正确的是( )
| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
11.下列事实不能用电化学原理解释的是( )
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
18.标准状况下,乙烷与炔烃X组成的混合烃22.4L与过量的氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度,气体的总体积缩小了44.8L,则炔烃X是( )
| A. | C2H2 | B. | C3H4 | C. | C4H6 | D. | C5H8 |
8.下列说法正确的是( )
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
15.在如图装置中,铁片上没有气泡产生的是( )


| A. | A | B. | B | C. | C | D. | D |
9.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国).下列说法不正确的是( )
| A. | Ds原子在周期表中位于第7周期第Ⅷ族 | |
| B. | Ds是IB元素 | |
| C. | Ds元素为放射性元素 | |
| D. | Ds元素在元素周期表中d区 |

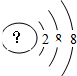 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.