题目内容
10.对于反应:S(g)+Cl2(g)?SCl2 (g)△H<0,下列措施中能增大正反应速率且平衡常数不变的是( )| A. | 通入大量的Cl2 | B. | 增大容器容积 | C. | 移去部分SCl2 | D. | 升高温度 |
分析 平衡常数只有温度有关,增大浓度、压强、温度均可加快反应速率,以此来解答.
解答 解:A.通入大量的Cl2,反应物浓度增大,正反应速率增大,但K不变,故A选;
B.增大容器容积,压强减小,正反应速率减小,但K不变,故B不选;
C.移去部分SCl2,生成物浓度减小,平衡正向移动,但正反应速率减小,K不变,故C不选;
D.升高温度,正反应速率增大,但该反应为放热反应,平衡逆向移动,K减小,故D不选;
故选A.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意K只与温度有关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列离子能大量共存,且满足相应要求的是( )
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH浓溶液立刻有气体产生 |
| D | Na+、HCO3-、Cl-、SO42- | 滴加Al2(SO4)3溶液立刻有沉淀和气体产生 |
| A. | A | B. | B | C. | C | D. | D |
1.化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
| A. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ | |
| C. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
18.下列有关电解质溶液的说法正确的是( )
| A. | 氨水与氯化铵的混合溶液显中性则:c(Cl-)>c(NH4+) | |
| B. | 0.2 mol/L的亚硫酸氢钠溶液中:c(OH -)+c(SO32-)=c(H+)+c(H2SO3) | |
| C. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,0.05 mol/LCH3COONa和0.05 mol/LCH3COOH等体积混合溶液:c( CH3COO-)+c(CH3COOH)=0.1 mol/L |
5.下列对浓硫酸的叙述中正确的是( )
| A. | 将1〜2滴浓硫酸滴入紫色石蕊试液中,溶液先变红后变黑 | |
| B. | 浓硫酸因为具有吸水性,所以可以使蔗糖炭化 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性 | |
| D. | 浓硫酸和铜片在加热条件下反应时,浓硫酸既表现出酸性,又表现出强氧化性 |
15.氯元素在自然界的主要存在形式是( )
| A. | Cl2 | B. | HCl | C. | NaCl | D. | KClO3 |
1.下列各组离子在指定条件的水溶液中能大量共存的是( )
| A. | 使石蕊变红色溶液:Ca2+、K+、HCO3-、Cl- | |
| B. | 强碱性的无色溶液:Na+、Ba2+、OH-、Cl- | |
| C. | PH=7的无色溶液:NH4+、Mg2+、MnO4-、HCO3- | |
| D. | 加锌能产生氢气的溶液:H+、Cu2+、CO32-、NO3- |
18.手指上有油脂(有机物)、氯化钠、水等分泌物,将按有指纹的白纸置于盛有少量单质碘的烧杯上,微热,即可显现出棕色指纹.下列碘的性质与该实验无关的是( )
| A. | 易升华 | B. | 蒸气呈紫色 | C. | 易溶于油脂 | D. | 与淀粉显蓝色 |
19.聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取: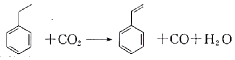
下列有关苯乙烯的说法正确的是( )

下列有关苯乙烯的说法正确的是( )
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |