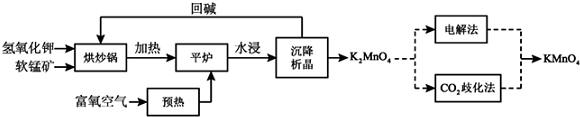
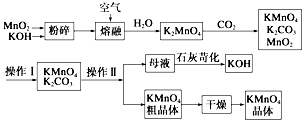
题目内容
5.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下.已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃).
(1)硼氢化钠(NaBH4)的电子式为
 ;其中B元素的化合价为+3
;其中B元素的化合价为+3(2)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是:排尽装置内空气及水汽
(3)请配平第①步反应的化学方程式:1NaBO2+2SiO2+4Na+2H2-1NaBH4+2Na2SiO3
(4)第②步操作需要的玻璃仪器有:烧杯、玻璃棒、漏斗;第③步分离(NaBH4)并回收溶剂,采用的方法是蒸馏.
分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解于异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4;
(1)NaBH4中Na为+1价,B为+3价,可结合化合物中各元素正负化合价代数和为0,计算出氢元素的化合价,①反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平方程式;
(2)原料中的金属钠通常保存在煤油中,需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,为防止安全事故发生和防止NaBH4水解,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,从而排出空气和水蒸气;
(3)根据转移电子守恒、原子守恒配平方程式;
(4)分离难溶性固体和溶液采用过滤;熔沸点相差较大的可以采用蒸馏方法.
解答 解:(1)NaBH4中根据化合物中各元素正负化合价代数和为0,并结合Na为+1价、B为+3价计算出H为-1价,第①步反应中根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,电子转移数目为4e-,
故答案为: ;+3;
;+3;
(2)钠的密度大于煤油,为隔绝空气和水,原料中的金属钠通常保存在煤油中,实验室取用少量金属钠时,需要镊子夹取钠、用滤纸吸煤油,所以实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出,钠极易和空气中氧气、和水反应,
故答案为:除去装置中的空气和水蒸气;
(3)第①步反应中根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
故答案为:1,2,4,2-1,2;
(4)分离难溶性固体和溶液采用过滤方法,需要的玻璃仪器有烧杯、玻璃棒、漏斗;②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,所以第②步分离采用的方法是过滤;熔沸点相差较大的可以采用蒸馏方法,异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
故答案为:烧杯、玻璃棒、漏斗;蒸馏.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、热化学反应方程式的书写、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.

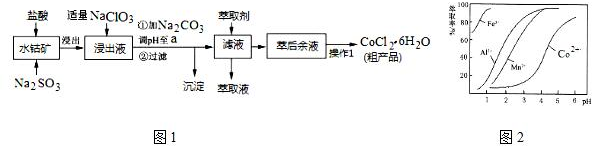
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
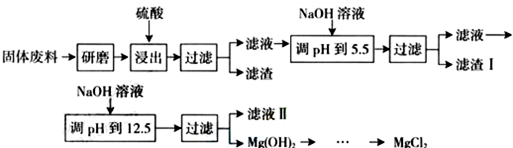
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
(2)滤渣I的主要成分有Fe(OH)3、Al(OH)3.
(3)从滤液Ⅱ中可回收利用的主要物质有Na2SO4.
(4)若将MgCl2溶液加热蒸干得到的固体是Mg(OH)2,若要得到MgCl2应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干.
(5)用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O.
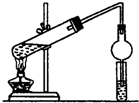 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.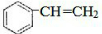 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为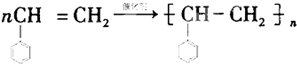 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.