题目内容
10.高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如下: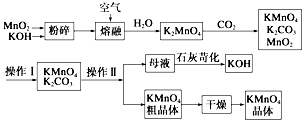
请回答下列问题:
(1)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是bd(填字母).
a.75%酒精 b.双氧水 c.苯酚 d. 84消毒液(NaClO溶液)
(3)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:2MnO2+4KOH+O2 $\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(4)上述流程中可以循环使用的物质有KOH、MnO2(写化学式).
(5)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀.当溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点.写出该反应的离子方程式:2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(6)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13.工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=2.4×10-5mol/L.
(7)操作Ⅰ的名称是过滤;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用浓缩结晶(填操作步骤)、趁热过滤得到KMnO4粗晶体.
分析 将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH,
(1)实验室利用碳酸钙与盐酸反应制二氧化碳;
(2)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用,根据流程图可知循环的物质;
(5)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,根据元素守恒和电荷守恒书写离子方程式;
(6)根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可计算出c(Mn2-);
(7)将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体.
解答 解:(1)实验室利用碳酸钙与盐酸反应制二氧化碳,反应的方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选bd,
故答案为:bd;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂,故答案为;K2MnO4;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,
故答案为:KOH;MnO2;
(5)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,反应的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+,
故答案为:2MnO4-+3Mn2++2H2O═5MnO2↓+4H+;
(6)当pH=10时,c2(OH-),c(OH-)=1×10-4 mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可知c(Mn2-)=$\frac{Ksp(Mn(OH)_{2})}{{c}^{2}(O{H}^{-})}$=$\frac{2.4×1{0}^{-13}}{(1×1{0}^{-4})^{2}}$=2.4×10-5mol/L,
故答案为:2.4×10-5mol/L;
(7)将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,所以操作Ⅰ为过滤,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,
故答案为:过滤; 浓缩结晶.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,题目难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3 |
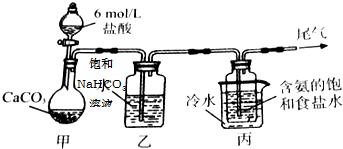
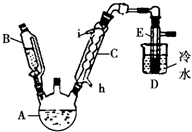 如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.
如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情况下状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)冷却剂应从h(填“h”或“i”)口进入冷凝管C中,制备操作中,加入的浓硫酸必须进行适当稀释,其目的(或原因)是b(填字母).
a.水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发
(3)加热的目的是加快反应速率且使溴乙烷汽化,使用D进行冷却的原因是使溴乙烷液化便于收集.
(4)A中液面上有深红棕色气体出现,写出生成它的化学方程式2HBr+H2SO4(浓)$\stackrel{△}{→}$Br2↑+2H2O+SO2↑,写出A中生成溴乙烷的化学方程式HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O.
(5)将E中产品转入到分液漏斗中,再向漏斗中加入适量Na2SO3溶液,振荡静置后分液.加入Na2SO3溶液的目的是除去单质溴等杂质,分液时目标产物离开漏斗的方式是从下面的导管排出来.
已知:2Na2CO3+3H2O2=2Na2CO3•3H2O2△H<0;回答下列问题:
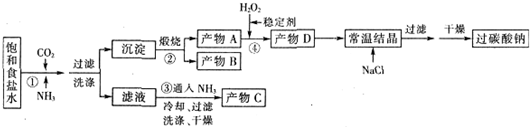
(1)下列物质可使过碳酸钠较快失效的是(填序号)ABC.
A.FeCl3溶液 B.H2S C.稀硫酸 D.NaHCO3溶液
(2)反应①应先通入的气体是氨气.写出反应①的化学方程式NaCl+CO2+NH3+H2O═NH4Cl+NaHCO3↓(写总反应)
(3)加入NaCl的作用是降低2Na2CO3•3H2O2的溶解度,析出更多晶体.
(4)该生产流程中可循环使用的物质是CO2(填化学式).
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作名称是晶体的洗涤;进行该操作的方法是沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作2-3次.
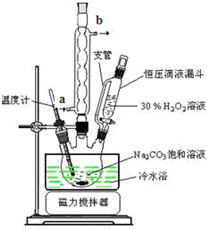
(6)实验室利用图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是使液体顺利流下,冷凝管应从a处进水.
(7)由实验测定反应温度对产物的影响如表:根据表数据,你认为反应最佳的温度选择的范围是15~20℃.
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
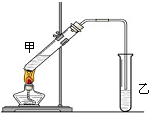 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.
CH3COOC2H5+H2O、CH3COOH+Na2CO3=NaHCO3+CH3COONa.
 ;其中B元素的化合价为+3
;其中B元素的化合价为+3
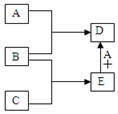 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).