题目内容
2.如图1为元素周期表的一部分,其中编号代表对应的元素.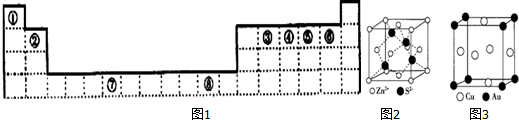
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式3d54S1,元素⑧位于ds区.⑤元素原子的价层电子的电子排布图为
 ,
,(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为SP2和SP3.
(3)元素③④⑤⑥的第一电离能由大到小的顺序是F>N>O>C(用元素符号表示).请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式N2O,(写出一种即可)其VSEPR构型为直线形.
(4)ZnS的晶胞结构如图2所示,在ZnS晶胞中,S2-的配位数为4.
(5铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1mol(SCN)2分子中含有共价键的数目为9NA.铜与金形成的金属互化物结构如图3,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}•{a}^{3}×1{0}^{-21}}$g•cm-3(用含“a、NA 的代数式表示)g•cm-3.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、Be、C、N、O、F、Cr、Cu元素.
(1)元素⑦的基态原子外围电子为3d、4s电子,根据构造原理书写其外围电子排布式,根据最后填入电子名称确定区域名称,⑤是O元素,其2S、2P电子为其原子价电子;
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则这三种元素的原子个数之比=$\frac{1}{1}$:$\frac{6}{12}$:$\frac{16}{16}$=2:1:2,该化合物对氢气的相对密度为23,则该化合物的相对分子质量为46,所以分子式为CH2O2,为HCOOH,根据价层电子对互斥理论确定原子杂化类型;
(3)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;
由④和⑤两种元素形成的与N3ˉ互为等电子体的分子是N2O,根据价层电子对互斥理论确定其VSEPR构型;
(4)根据晶胞的结构图可求S2-的配位数;
(5)根据(SCN)2分子的结构N≡C-S-S-C≡N解答,根据均摊法计算出晶胞中Cu、Au原子数,根据$\frac{m}{V}$计算密度.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、Be、C、N、O、F、Cr、Cu元素.
(1)元素⑦的基态原子外围电子为3d、4s电子,根据构造原理书知其外围电子排布式为3d54s1,该元素位于ds区,⑤是O元素,其2S、2P电子为其原子价电子,则⑤元素原子的价层电子的轨道表示式为 ,
,
故答案为:3d54s1;ds; ;
;
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,则这三种元素的原子个数之比=$\frac{1}{1}$:$\frac{6}{12}$:$\frac{16}{16}$=2:1:2,该化合物对氢气的相对密度为23,则该化合物的相对分子质量为46,所以分子式为CH2O2,为HCOOH,C原子和羰基上O原子都含有3个σ键,所以为sp2杂化,羟基上O原子含有2个σ键和2个孤电子对,所以为sp3杂化,
故答案为:sp2;sp3;
(3)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以③④⑤⑥的第一电离能由大到小的顺序为F>N>O>C,由④和⑤两种元素形成的与N3ˉ互为等电子体的分子是N2O,该分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×3)=2,所以为直线形分子,
故答案为:F>N>O>C;N2O;直线形;
(4)根据图1,距离S2-最近的锌离子有4个,即S2-的配位数为4,
故答案为:4;
(5)(SCN)2分子的结构N≡C-S-S-C≡N,1mol(SCN)2分子中含有共价键的数目为为9NA,Cu原子位于晶胞面心,数目为6×$\frac{1}{2}$=3,Au原子为晶胞顶点,数目为8×$\frac{1}{8}$=1,晶胞体积V=(a×10-7)3,密度$\frac{m}{V}$=$\frac{64×3+197}{\frac{{N}_{A}}{{a}^{3}×1{0}^{-21}}}$=$\frac{389}{{N}_{A}•{a}^{3}×1{0}^{-21}}$g•cm-3,
故答案为:9NA;$\frac{389}{{N}_{A}•{a}^{3}×1{0}^{-21}}$g•cm-3.
点评 本题考查了元素周期表和元素周期律的综合应用,涉及原子杂化方式的判断、微粒空间构型的判断、晶体的密度求算等知识点,根据价层电子对互斥理论、原子结构等知识点来分析解答,注意第一电离能规律中的异常现象,为易错点,掌握根据均摊法计算晶胞原子个数的高频考题技巧,题目难度中等.

| A. | 用试管取出试剂瓶中的 Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有 Ba(NO3)2 的废液倒入水池中,再用水冲入下水道 | |
| C. | 用蒸发方法使 NaCl 从溶液中析出时,应将蒸发皿中 NaCl 溶液全部蒸干才停止加热 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| C. | 用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 | |
| D. | 用焰色反应鉴别NaCl和KNO3 |
| A. | 盐酸、硫酸、五水硫酸铜 | B. | NH3、Cu、空气 | ||
| C. | NaOH、SO2、空气 | D. | 氨水、食盐、酒精 |
a.12g 金刚石中含有的碳碳键的数目为2NA
b.1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c.1mol Na2O2与水反应转移的电子数为NA
d.常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e.标准状况下,2.24L C6H14含原子总数大于2NA
f.17g H2O2中含有的电子数为9NA
g.将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h.常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
| A. | CO用于高炉炼铁 | |
| B. | 用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) | |
| C. | 用盐酸除铁锈(铁锈主要成分是Fe2O3) | |
| D. | 用小苏打(NaHCO3)治疗胃酸过多 |
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是( )| A. | 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题 | |
| B. | 大烧杯上如不盖硬纸板,测得的中和热数值会偏大 | |
| C. | 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大 | |
| D. | 实验中改用60 mL 0.50 mol•L-1盐酸跟50 mL 0.55 mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等,但是所求中和热相等 |