题目内容
12.实验中的下列操作正确的是( )| A. | 用试管取出试剂瓶中的 Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有 Ba(NO3)2 的废液倒入水池中,再用水冲入下水道 | |
| C. | 用蒸发方法使 NaCl 从溶液中析出时,应将蒸发皿中 NaCl 溶液全部蒸干才停止加热 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
分析 A、过量的试剂不能倒回试剂瓶中,防止污染试剂;
B、钡离子属于重金属离子,容易造成水污染;
C、蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干;
D、容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体.
解答 解:A、过量的试剂不能倒回试剂瓶中,防止污染试剂,应放在指定的烧杯中,故A错误;
B、由于钡离子属于重金属离子,能够导致人或牲畜中毒,污染地下水,所以不可将含有Ba(NO3)2的废液倒入水池中,应该倒入指定的回收缸中,故B错误;
C、蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干,防止晶体迸溅,故C错误;
D、容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,浓硫酸溶于水放热,溶液的温度较高,应冷却后在转移到容量瓶中,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法及分离原理为解答的关键,侧重实验基本操作和基本技能的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.分子式为C10H12O2的有机物,其苯环上只有两个取代基,且能与NaHCO3,溶液反应产生气体的结构(不是立体异构)有( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
20.高效水处理剂ClO2在实验室中通过以下反应制得:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | CO2 是氧化产物 | |
| B. | 1mol KClO3 参加反应,转移的电子为1mol | |
| C. | KClO3 在反应中被氧化 | |
| D. | H2C2O4的还原性强于ClO2 的还原性 |
7.某化工厂冶炼金属、回收硫的工艺流程如图甲:

Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
铜盐溶液中Fe2,Zn2+对精炼铜可能会产生影响.工业上,除去Fe2+方法是,在酸性混合溶液中加入双氧水(选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.加入碱调节溶液pH范围为3.7<pH<4.6.

Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
17.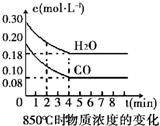 在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min-4min之间反应处于平衡状态;C1数值大于0.08mol/L (填大于、小于或等于).
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min-5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min-6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
4.下列说法正确的是( )
| A. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| B. | pH=2和pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 | |
| D. | pH=1的硫酸中加入等体积0.1 mol/L的BaCl2溶液,两者恰好反应 |
1.对于有机物 的叙述中不正确的是( )
的叙述中不正确的是( )
 的叙述中不正确的是( )
的叙述中不正确的是( )| A. | 常温下,与Na2CO3溶液反应放出CO2 | |
| B. | 能发生水解反应,1 mol 该有机物能与8 mol 的NaOH反应 | |
| C. | 与稀硫酸共热能生成两种有机物 | |
| D. | 该物质的化学式是C14H10O9 |
 K增大的有A(填字母)
K增大的有A(填字母)
 ,
,