题目内容
16.1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的.现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).

(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
分析 (1)依据反应②平衡常数随温度变化分析判断平衡移动方向,图表中的数据可知平衡常数随温度升高而增大;
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系分析,温度不变平衡常数不变;书写反应①②③的平衡常数表达式,结合特征就是得到反应③的平衡常数,分析反应特征可知平衡常数K3=K1×K2;
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
(4)甲醇燃料电池中燃料在负极失电子发生氧化反应,碱溶液中甲醇失电子生成碳酸根离子;
解答 解:(1)图表中反应②平衡常数随温度变化,500°C变化到800°C,平衡常数从1.0变化为2.5,温度升高平衡常数增大,平衡正向进行,说明正反应是吸热反应;
故答案为:吸热;
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系分析,平衡状态由A变到B时温度不变,平衡常数不变,K(A)=K(B),
①2H2(g)+CO(g)?CH3OH(g),平衡常数K1=$\frac{[C{H}_{3}OH]}{[{H}_{2}]^{2}[CO]}$,②2H2(g)+CO2(g)?H2O+CO(g),平衡常数K2=$\frac{[CO][{H}_{2}O]}{[{H}_{2}]^{2}[C{O}_{2}]}$
依据反应①+②得到反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g),平衡常数K3=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[{H}_{2}]^{3}[C{O}_{2}]}$=$\frac{[C{H}_{3}OH]}{[{H}_{2}]^{2}[CO]}$×$\frac{[CO][{H}_{2}O]}{[{H}_{2}]^{2}[C{O}_{2}]}$,所以平衡常数K3=K1×K2,
故答案为:=,K1•K2;
(3)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂,当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ时容器体积为3L,一氧化碳浓度为3mol/L,改变条件变化为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合,
故答案为:加入催化剂,将容器的体积快速压缩至2L;
(4)甲醇燃料电池中燃料在负极失电子发生氧化反应,碱溶液中甲醇失电子生成碳酸根离子,负极电极反应为:CH3OH-6 e-+8 OH-=CO32-+6 H2O,
故答案为:CH3OH-6 e-+8 OH-=CO32-+6 H2O;
点评 本题考查了化学平衡常数、化学平衡影响因素、图象变化特征的分析,原电池原理的应用,主要是弱电解质电离平衡常数的计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硫酸钠 | D. | 氯化氢气体 |
(1)步骤1:
| 加入试剂 | 被检出物质 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液显蓝色 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| CuSO4 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| MgCl2 |
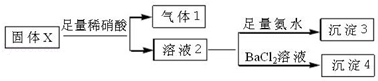
根据上述实验,以下说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. | 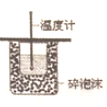 装置依据测定酸碱中和反应的中和热 | |
| C. | 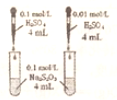 装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. | 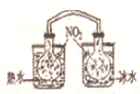 装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
