题目内容
20.在一个恒容绝热的密闭容器中,发生可逆反应:M(?)+2N(g)?P(g)+Q(g) 该反应为吸热反应,已知M的状态未知,则下列描述一定达到平衡的标志是( )①当物质M、N、P的体积分数比为 1:1:1时 ②混合气体的密度不变时
③体系的温度不变时 ④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时 ⑥气体的平均相对分子质量不变时.
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:M(?)+2N(g)═P(g)+Q(g)△H>0,
①平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故M、N、P的体积分数比为 1:1:1时不能作为判断是否达到平衡状态的依据,故①错误;
②M的状态未知,故气体的总质量是否变化未知,体积不变,故混合气体的密度不变时不一定能作为判断是否达到平衡状态的依据,故②错误;
③该反应为放热反应,体系的温度不变,说明达到平衡状态,故③正确;
④反应速率2v (N)正=v (Q)逆时,化学反应速率之比与化学计量数之比不等,故不能说明达到平衡状态,故④错误;
⑤容器为绝热容器,压强不变,说明体系的温度不变,说明达到平衡状态,故⑤正确;
⑥平均分子量=$\frac{总质量}{总物质的量}$,若M为气体,则总质量不变,总物质的量会变;若M不为气体,则总质量会变,总物质的量不变,故气体的平均相对分子质量不变时可作为判断是否达到化学平衡状态的依据,故⑥正确;
故一定达到平衡的标志是③⑤⑥,
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征和反应特征,平衡移动原理是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关说法正确的是( )
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
11.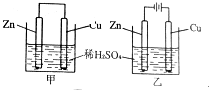 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )
 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )| A. | 甲乙装置中的铜片都作正极 | |
| B. | 甲乙装置中的溶液内的H+均在锌片上被氧化 | |
| C. | 甲乙装置中锌片上发生的反应都是还原反应 | |
| D. | 甲装置中铜片上有气泡生成,乙装置中的铜片质量减小 |
8.下列实验的现象与对应的结论均正确的是( )
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
15.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:

部分含钒物质在水中的溶解性如表:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
9. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度.
向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD.
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-)
B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-)
D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
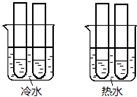
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度.
向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD.
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-)
B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-)
D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
10.实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L.,下面四个选项中能达到此目的是( )
| A. | Al3+、K+、SO42-、Cl-、Al[(OH)4]- | B. | Al3+、Na+、Cl-、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Fe2+、H+、Br-、NO3-、Cl- |

 +H2O
+H2O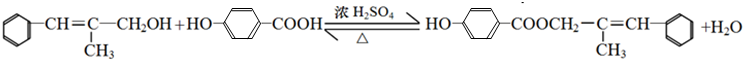
 .
.