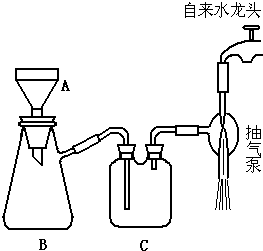
题目内容
9. 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度.
向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD.
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-)
B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-)
D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
分析 (1)常温下0.01mol/L的H2C2O4pH为2.1,KHC2O4,的pH为3.1,说明草酸是二元弱酸;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
A.根据物料守恒判断;
B.根据电荷守恒判断;
C.根据物料守恒、电荷守恒判断;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些;
(3)草酸和高锰酸钾溶液反应在酸性溶液中 发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子;反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用;
(4)两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的物质的量之比为5:2,据此分析.
解答 解:(1)二元弱酸分步电离,草酸电离方程式为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
A.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒有c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A正确;
B.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故B错误;
C.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故C错误;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故D正确;
故答案为:HC2O4-的电离程度大于水解程度;AD;
(3)草酸和高锰酸钾溶液反应在酸性溶液中 发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用,
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;反应生成的Mn2+对该反应具有催化作用;
(4)两烧杯中水的温度不同,该实验是研究温度对反应速率的影响;草酸与高锰酸钾反应的物质的量之比为5:2,试管中草酸与高锰酸钾物质的量之比为1:2,高锰酸钾过量,不能完全反应,所以不褪色,
故答案为:温度对反应速率的影响;KMnO4溶液过量.
点评 本题考查弱电解质的电离平衡及其应用,题目难度中等,涉及草酸的电离方程式书写、电解质溶液中的电荷守恒和物料守恒、草酸的还原性以及影响化学反应速率的因素的探究,试题培养了学生的分析能力及灵活应用能力.

| A. | 电解熔融的氯化钠制取钠 | B. | 用一氧化碳还原氧化铁制取铁 | ||
| C. | 加热分解氧化汞制取汞 | D. | 铁与硫酸铜溶液反应制取铜 |
①当物质M、N、P的体积分数比为 1:1:1时 ②混合气体的密度不变时
③体系的温度不变时 ④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时 ⑥气体的平均相对分子质量不变时.
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
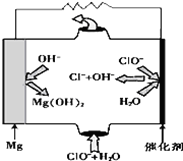 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
| A. | 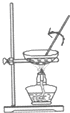 图:从FeCl2溶液中制取FeCl2晶体 | |
| B. | 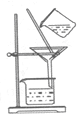 图:从制取Fe(OH)2胶体的混合物中提纯胶体 | |
| C. | 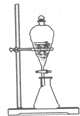 图:用CCl4萃取,从溴水中得到纯溴 | |
| D. | 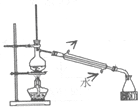 图:分离苯和甲苯 |
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn互为同素异形体 |
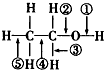
| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
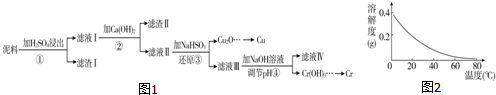
已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液Ⅰ中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加入Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5 mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{64}$≈4.0;lg 4=0.6.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.