题目内容
18.推动上千吨的火箭和进行长距离的太空飞行的巨大能量是从哪里来的?化学反应立下神功.火箭使用的燃料是偏二甲肼[(CH3)2NNH2],火箭升空时发生的化学反应为:C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑.下列有关该反应的说法正确的是( )| A. | 偏二甲肼既是氧化剂又是还原剂 | |
| B. | 该反应进行时只有放热过程没有吸热过程 | |
| C. | 该反应中氮元素的化合价升高 | |
| D. | 该反应中每生成1mol CO2转移8mol电子 |
分析 在反应C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O中,C2H8N2中N元素的化合价为-3价,H为+1价,C为-1价,N2O4中N为+4价,根据化合价的变化解答该题.
解答 解:A.C2H8N2中N元素的化合价为-3价,反应时化合价的变化为:C化合价由-1价升高为+4价,N化合价由-3价升高为0价,则该反应中C2H8N2为还原剂,被氧化,故A错误;
B.反应放热,为火箭升空提供能量,水由液态生成气态为吸热过程,故B错误;
C.该反应的反应物C2H8N2中C化合价由-1价升高为+4价,N化合价由-3价升高为0价,C和N元素的化合价都升高,故C正确;
D.2molN2O4反应得到2×2×(4-0)mol=16mol电子,生成2molCO2,则生成1molCO2,转移8mol电子,故D正确.
故选CD.
点评 本题考查氧化还原反应,为高频考点,注意正确分析各元素化合价的变化为解答该题的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
16.下列关于同分异构体数目的叙述不正确的是( )
| A. | 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯代物有3种 | |
| D. | 菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
6.将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后得到浊液a,过滤得到滤液b和白色沉淀c.下列分析不正确的是( )
| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
3.室温下,测得Ca(ClO)2溶液中c(ClO-)=0.1mol•L-1,下列判断中错误的是( )
| A. | 加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大 | |
| B. | 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+) | |
| C. | 溶液中2c(Ca2+)+c(H+)=c(ClO-)+c(OH-) | |
| D. | 若溶液的pH=l2,则c(ClO-)的水解百分率约为9.1% |
10.将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3下列关于该反应的说法中正确的是( )
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
7.下列贮存化学试剂的方法正确的是( )
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 溴水存放在带玻璃塞的无色试剂瓶中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
8.在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
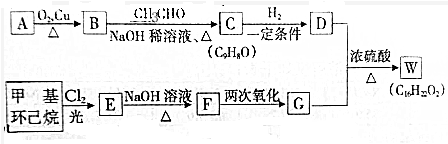
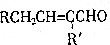 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)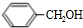 ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称).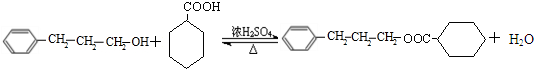 .
.