题目内容
下列实验能达到预期目的是( )
| A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液 |
| B、向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾 |
| C、向煮沸的1mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| D、利用丁达尔效应可区别Na2CO3溶液与Al(OH)3胶体 |
考点:化学实验方案的评价,胶体的重要性质,物质的分离、提纯和除杂,物质的检验和鉴别的实验方案设计
专题:实验评价题
分析:A.先加硝酸银溶液,二者均转化为沉淀;
B.碳酸钾与盐酸反应生成氯化钾;
C.反应生成沉淀;
D.胶体具有丁达尔现象,而溶液不具有.
B.碳酸钾与盐酸反应生成氯化钾;
C.反应生成沉淀;
D.胶体具有丁达尔现象,而溶液不具有.
解答:
解:A.先加硝酸银溶液,二者均转化为沉淀,应先加硝酸钡,再加硝酸银,故A错误;
B.碳酸钾与盐酸反应生成氯化钾,则向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾,故B正确;
C.反应生成沉淀,应向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体,故C错误;
D.胶体具有丁达尔现象,而溶液不具有,则利用丁达尔效应可区别Na2CO3溶液与Al(OH)3胶体,故D正确;
故选BD.
B.碳酸钾与盐酸反应生成氯化钾,则向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾,故B正确;
C.反应生成沉淀,应向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体,故C错误;
D.胶体具有丁达尔现象,而溶液不具有,则利用丁达尔效应可区别Na2CO3溶液与Al(OH)3胶体,故D正确;
故选BD.
点评:本题考查化学实验方案的评价,为高频考点,涉及离子的检验、物质除杂、胶体制备、物质的鉴别等,把握物质的性质及化学反应原理为解答的关键,注意实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
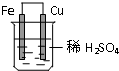 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )| A、正极的反应式为:Cu2++2e-=Cu |
| B、铁片逐渐溶解,反应式为:Fe-3e-=Fe3+ |
| C、负极是电子流入的电极 |
| D、铜片为正极,发生了还原反应,可观察到气泡产生 |
下列溶液中,物质的量浓度最大的是( )
| A、将40gNaOH溶于水并配成1L的溶液 |
| B、0.5 L含49gH2SO4的溶液 |
| C、将1molNa2O 溶于水并配成1L的溶液 |
| D、含K+为1mol?L-1的K2SO4溶液 |
下列各项值最精确的是( )
| A、S.T.P下,1mol任何气体的体积为22.4L |
| B、阿佛加德常数为6.02×1023/mol |
| C、设NA代表阿佛加德罗常数,则1mol H2分子数为NA个 |
| D、S.T.P下,0.5mol CO2的体积为11.2L |
在密闭容器中充入4molSO2和3molO2,一定条件下平衡:2SO2(g)+O2(g)?2SO3(g)△H=-a kJ/mol,反应中测得SO2的转化率为90%,则在此条件下反应放出的热量( )
| A、1.8a kJ |
| B、a kJ |
| C、2a kJ |
| D、0.9a kJ |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、标准状况下,22.4L H2含有的原子数为NA |
| B、等质量的O2和O3中所含分子数相等 |
| C、常温常压下,14g N2含有电子数为7NA |
| D、等质量的CO与CO2中所含碳原子数之比为7:11 |
将标况下的NH3溶于水中,得到密度为b g?cm-3的氨水a g,物质的量浓度为c mol?L-1,则溶于水中的NH3的体积是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列状态的物质,既能导电又属于电解质的是( )
| A、KCl溶液 |
| B、液态HCl |
| C、熔融的NaOH |
| D、蔗糖溶液 |