题目内容
6.某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等试验(图中夹持装置有省略).请按要求填空: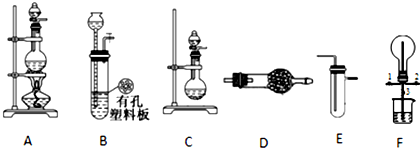
I.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与D(填装置编号)连接;装置C中的烧瓶内固体宜选用ad.
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是饱和食盐水、浓硫酸.
(3)装置F可用于探究氯气与氨气(已知氯气与 氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应.实验时打开开关1、3,关闭2,先向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成],证明固体中有NH4+.
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是装置E中的NaBr溶液变橙红色.
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式CH2═CH2+Br2→Br-CH2-CH2-Br.
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验.F的烧瓶中发生反应的化学方程式为SO2+2H2S═3S↓+2H2O;F的烧杯所起的作用是吸收尾气.
分析 (1)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,与制取干燥氨气可以用碱石灰干燥氨气;
(2)二氧化锰和浓盐酸加热反应制备氯气,浓盐酸易挥发,所以生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(3)实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,反应生成氯化铵,可根据铵根离子与碱反应生成氨气的方法检验;
(4)氯气的氧化性强于溴,可根据溴水的颜色判断;
(5)乙烯和溴水发生加成反应生成1,2-二溴乙烷;
(6)二氧化硫和硫化氢发生氧化还原反应生成硫,二氧化硫和硫化氢都可与碱液反应,防止污染空气.
解答 解:(1)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,制取干燥氨气可以用碱石灰干燥氨气;为制取干燥氨气,可将装置C连接D点的干燥的氨气,装置C中的烧瓶内固体宜选用浓氨水和生石灰或碱石灰,
故答案为:D;ad;
(2)二氧化锰和浓盐酸加热反应制备氯气,浓盐酸易挥发,所以生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,
故答案为:饱和食盐水、浓硫酸;
(3)实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,依据反应化学方程式判断是生成的氯化氢和氨气反应生成的氯化铵,检验铵根离子,可取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成],证明固体中有NH4+,
故答案为:氯气;取少量固体于试管中,加入适量浓NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,[或用蘸有浓盐酸(或浓硝酸)的玻璃棒放在试管口,若有白烟生成],证明固体中有NH4+;
(4)氯气氧化性强于溴,能够与溴离子发生氧化还原反应置换出溴,溴单质溶液水呈橙红色,故答案为:装置E中的NaBr溶液变橙红色;
(5)乙烯和溴水发生加成反应生成1,2-二溴乙烷,方程式为CH2═CH2+Br2→Br-CH2-CH2-Br,
故答案为:CH2═CH2+Br2→Br-CH2-CH2-Br;
(6)二氧化硫和硫化氢发生氧化还原反应生成硫,方程式为SO2+2H2S═3S↓+2H2O,二氧化硫和硫化氢都可与碱液反应,防止污染空气,
故答案为:SO2+2H2S═3S↓+2H2O;吸收尾气.
点评 本题考查综合考查物质的性质,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目涉及氨气、氯气、乙烯气体的制备及性质的检验,熟悉制备原理和物质的性质是解题关键,题目难度中等.

【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL0.1mol/L的MgCl2溶液中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀;(1)分别向两支试管中加入不同试剂,记录实验现象如表:
| 实验编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴 0.1mol/L FeCl3 溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②白色沉淀溶解,得无色溶液 |
(3)同学们猜想实验Ⅱ中沉淀溶解的原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动.
猜想2:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动.
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解.
①实验证明猜想正确的是1(填“1“或“2“).
②验证猜想时,设计实验向氢氧化镁沉淀中加NH4Cl和氨水混合液的理由是做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
| A. | 甲苯(苯酚):氢氧化钠,蒸馏 | B. | 乙酸丁酯(乙酸):碳酸钠,分液 | ||
| C. | 乙醇(苯酚):氢氧化钠,分液 | D. | 乙醇(乙酸):碱石灰,分液 |
| A. | 盐酸和氢氧化铜 | B. | 硫酸和氢氧化钠溶液 | ||
| C. | 醋酸和氢氧化钡溶液 | D. | 稀硝酸和氨水混合 |
| A. | 分散质粒子能做不停的,无规则的运动 | |
| B. | 是否有丁达尔现象 | |
| C. | 静置后既不分层,也无沉淀产生 | |
| D. | 分散质粒子直径在10-7-10-9m之间 |