题目内容
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
分析 A、5.6g铁粉即0.1mol铁粉在0.1mol氯气中燃烧,铁粉过量;
B、铜只能和浓硫酸反应,和稀硫酸不反应;
C、Na2S和Na2O2的摩尔质量均为78g/mol,且均由2个钠离子和1个阴离子构成;
D、常温下,铁在浓硝酸中钝化.
解答 解:A、5.6g铁粉即0.1mol铁粉在0.1mol氯气中燃烧,铁粉过量,氯气完全反应,且氯气反应后变为-1价,故0.1mol氯气转移0.2NA个电子,故A错误;
B、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能完全反应,故转移的电子小于0.04NA个,故B错误;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,且两者均由2个钠离子和1个阴离子构成,故0.1mol混合物中含0.1NA个阴离子,故C正确;
D、常温下,铁在浓硝酸中钝化,故不能反应完全,故转移的电子数小于0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.某溶液,由Na+、Ba2+、Al3+、AlO2-、CrO42-、CO32-、SO42-中的若干种组成.取适量该溶液进行如下实验:①加入过量盐酸有气体生成并得到无色溶液;②在①所得溶液中再加入过量NH4HCO3溶液,有气体生成并析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液也有气体生成并产生白色沉淀乙,则原沉淀中一定存在的离子是( )
| A. | Na+、AlO2-、CrO42-、CO32- | B. | Na+、AlO2-、CO32- | ||
| C. | Na+、AlO2-、CO32-、SO42- | D. | Na+、Ba2+、AlO2-、CO32- |
9.已知短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数 d>c>b>a | B. | 原子半径 A>B>D>C | ||
| C. | 离子半径 C2->D->B+>A2+ | D. | 阴离子的还原性C2-<D- |
19.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
3.二氧化硅是酸性氧化物的原因是( )
| A. | 它溶于水得到相应的酸 | B. | 它对应的水化物是可溶性强酸 | ||
| C. | 它与强碱反应只生成盐和水 | D. | 它是非金属氧化物 |
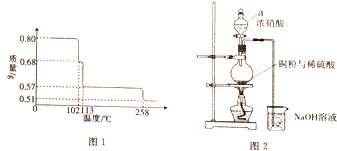 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题: