题目内容
16.某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL0.1mol/L的MgCl2溶液中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀;(1)分别向两支试管中加入不同试剂,记录实验现象如表:
| 实验编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴 0.1mol/L FeCl3 溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②白色沉淀溶解,得无色溶液 |
(3)同学们猜想实验Ⅱ中沉淀溶解的原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动.
猜想2:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动.
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解.
①实验证明猜想正确的是1(填“1“或“2“).
②验证猜想时,设计实验向氢氧化镁沉淀中加NH4Cl和氨水混合液的理由是做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
分析 (1)在Mg(OH)2悬浊液中,加0.1mol/L FeCl3溶液,会生成氢氧化铁沉淀;在Mg(OH)2悬浊液中,加2 mol/L NH4Cl 溶液,Mg(OH)2沉淀会溶解;
(2)根据Ksp[Fe(OH)3]计算溶液中c(Fe3+);
(3)铵根离子显酸性,氢离子与氢氧化镁反应;
(4)①醋酸铵为中性,如果醋酸铵能够溶解氢氧化镁固体,则证明猜想1正确;
②NH4Cl和氨水混合液(pH=8)中氢离子浓度很小,据此进行解答.
解答 解:(1)向2支均盛有1mL 0.1mol/L MgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀,
在Mg(OH)2悬浊液中,加0.1mol/L FeCl3溶液,会生成氢氧化铁沉淀,白色沉淀转化为红褐色沉淀;在Mg(OH)2悬浊液中,加2 mol/L NH4Cl 溶液,Mg(OH)2沉淀会溶解,形成无色溶解;
故答案为:
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 白色沉淀转化为红褐色沉淀 | |
| Ⅱ | 白色沉淀溶解,得无色溶液 |
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1{0}^{-8})^{3}}$=4×10-14mol/L,故答案为:4×10-14mol/L;
(3)猜想2:在Mg(OH)2悬浊液中,存在沉淀溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH -(aq),铵根离子显酸性,NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动,所以氢氧化镁沉淀溶解;
故答案为:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动;
(4)①已知醋酸铵为中性,在盛有氢氧化镁沉淀的试管中,加入醋酸铵溶液,能够溶解氢氧化镁固体,则证明猜想1正确;
故答案为:1;
②NH4Cl和氨水混合液(pH=8)中氢离子浓度很小,在盛有氢氧化镁沉淀的试管中,加入NH4Cl和氨水混合液,能够溶解氢氧化镁固体,说明Mg(OH)2溶解不是与氢离子发生反应;
故答案为:做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
点评 本题考查较为综合,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握影响沉淀平衡,电离平衡和水解平衡的因素,综合把握相关基本理论知识,注重基础知识的学习.

练习册系列答案
相关题目
3.丁烷(CH3CH2CH2CH3)的二氯代物有( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.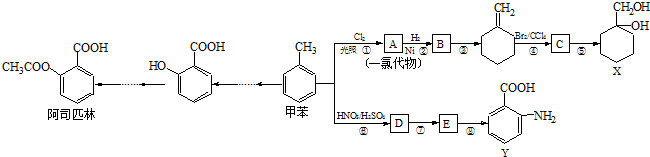
 ,C
,C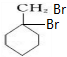 ,E
,E .
.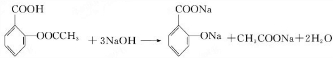 .
. Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中半径最小的元素,W与Y组成的化合物是温室气体、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物. .
.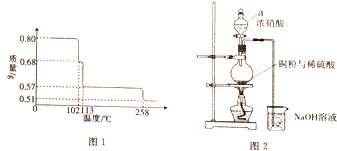 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题: