题目内容
16.常温下,某无色透明的溶液中,下列各组离子能够大量共存的是( )| A. | H+、Na+、Cl-、HCO3- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | MnO4-、K+、S2-、H+ | D. | Mg2+、Cl-、NO${\;}_{3}^{-}$、H+ |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.氢离子与碳酸氢根离子反应;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.高锰酸根为有色离子,且高锰酸根离子在酸性条件下具有强氧化性,能够氧化硫离子;
D.四种离子之间不发生反应,且为无色溶液.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.H+、HCO3-之间发生反应,在溶液中不能大量共存,故A错误;
B.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,MnO4-、S2-、H+之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Mg2+、Cl-、NO3-、H+之间不发生反应,都是无色离子,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
相关题目
6.下列化合物不属于有机物的是( )
| A. | CH3CH2OH | B. | CH3COOH | C. | CH3COOCH3 | D. | CO2 |
7.下面有关晶体的叙述中,正确的是( )
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有4个碳原子 | |
| B. | 12 g石墨中含有4NA个C-C键 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻6个CO2分子 |
4.下列有关物质的表达式正确的是( )
| A. | 乙炔分子的球棍模型: | B. | 羟基的电子式: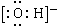 | ||
| C. | 2氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: |
11.某化合物的结构(键线式)图1及球棍模型如图2如下:

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )

该有机分子的核磁共振氢谱图如图3下(单位是ppm)下列关于该有机物的叙述,不正确的是( )
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH2CH3 | |
| D. | 1 mol 该有机物完全燃烧可以产生 6 mol水 |
1.某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| A. | 放电时,负极上Fe发生还原反应 | |
| B. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 | |
| C. | 放电时,Ni(OH)2是还原产物 | |
| D. | 该蓄电池放电过程和充电过程发生的是可逆反应 |
8.已知723K时,2S02(g)+02(g)?2S02(g)△H=-Q,在相同条件下,向一密闭容器中通入2molS02和1mol02,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1molS02和0.5mol02,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
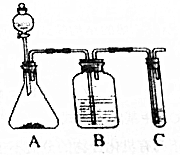 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.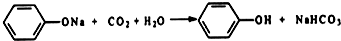 ;
;