题目内容
2.下列能量转化过程中属于放热反应的是( )| A. | 铝热反应 | B. | 浓硫酸稀释 | ||
| C. | 冰雪融化 | D. | 绿色植物的光合作用 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化、某些复分解(如铵盐和强碱).
解答 解:A.铝热反应是放热反应,故A正确;
B.浓硫酸稀释过程中放热,是物质溶解不是化学反应,故B错误;
C.冰雪融化吸收热量,是物理变化,故C错误;
D.植物利用光能将二氧化碳和水合成碳水化合物和氧气,因为碳水化合物和氧气的总能量大于水和二氧化碳的总能量所以总反应为吸热反应,故D错误;
故选A.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
12.某同学到了傍晚时就看不见东西,患了夜盲症,他体内缺少的维生素可能是( )
| A. | 维生素D | B. | 维生素C | C. | 维生素B | D. | 维生素A |
13.已知空气-锌电池的电极反应如下:
锌电极:Zn+2OH--2e-═ZnO+H2O;
石墨电极:$\frac{1}{2}$O2+H2O+2e-═2OH-.
可以判断石墨电极是( )
锌电极:Zn+2OH--2e-═ZnO+H2O;
石墨电极:$\frac{1}{2}$O2+H2O+2e-═2OH-.
可以判断石墨电极是( )
| A. | 负极,发生还原反应 | B. | 正极,发生氧化反应 | ||
| C. | 负极,发生氧化反应 | D. | 正极,发生还原反应 |
10.对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液( )
| A. | ①③④⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | ②③④ |
17. BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法错误的是( )
出发合成BHT的方法有如下两种.下列说法错误的是( )| A. | 从绿色化学角度分析方法一优于方法二 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | BHT与 都能使酸性KMnO4溶液褪色 都能使酸性KMnO4溶液褪色 |
7.分析如图,不能得出的结论是( )
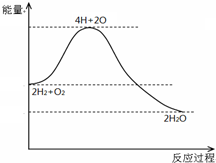

| A. | H2与O2反应是放热反应 | |
| B. | 断开化学键要放出能量 | |
| C. | 化学反应伴随着物质变化和能量变化 | |
| D. | 2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量 |
14.下列各组物质中,只用溴水就能鉴别的一组是( )
| A. | 己烯、苯、苯酚 | B. | 苯、甲苯、乙醇 | C. | 汽油、煤油、甘油 | D. | 乙烷、乙烯、乙炔 |
11.下列说法正确的是( )
| A. | 干冰气化和I2升华克服的是共价键 | |
| B. | CH3CH2OH和CH3OCH3分子式相同,它们互为同分异构体 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的Si3N4固体是分子晶体 |
12.下列反应方程式书写正确的是( )
| A. | 甲醛和足量银氨溶液充分反应:HCHO+2Ag(NH3)2++2O- $\stackrel{加热}{→}$ HCOO-+NH4++2Ag↓+H2O+3NH3 | |
| B. | 往苯酚钠溶液中通入少量二氧化碳气体: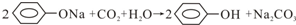 | |
| C. | 向盛有硫酸铜水溶液的试管里加入过量氨水:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O | |
| D. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |