题目内容
8.下列描述中正确的是( )| A. | SO2和SO32-的中心原子均为sp3杂化 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | 分子晶体的堆积均采取分子密堆积 | |
| D. | CS2为V形的极性分子 |
分析 A.先求出中心原子的价层电子对数,再判断杂化类型,SO2为sp2杂化;
B.根据价层电子对互斥理论确定其杂化方式及空间构型;
C.分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积;
DCS2与CO2分子构型相同,根据二氧化碳的分子结构分析.
解答 解:A.SO2中S原子的价层电子对数=2+$\frac{1}{2}$×(6-2×2)=3,为sp2杂化,SO32-中S的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,所以中心原子均为sp3杂化,故A错误;
B.ClO3-中价层电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,且含有一个孤电子对,所以是三角锥型,故B正确;
C.分子晶体的堆积不一定是分子密堆积,如冰晶体中存在氢键,不是分子密堆积,故C错误;
D.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O为非极性分子,则CS2的结构为S=C=S,属于直线形分子,为非极性分子,故D错误;
故选B.
点评 本题考查了原子杂化方式的判断、极性分子和分子密堆积的判断,根据价层电子对互斥理论来分析解答即可,题目难度中等.

练习册系列答案
相关题目
16.区别二氧化硫气体和二氧化碳气体的方法最佳是( )
| A. | 通入澄清的石灰水 | B. | 根据有无毒性 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 用品红溶液 |
3. 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 阴极的电极反应式为:Cl-+2OH--2e -=ClO-+H2 O | |
| B. | 阳极的电极反应式为:2CN-+12OH--10e-=N2↑+2CO 32-+6H2O | |
| C. | 电解时使用锂钒氧化物二次电池(V2O5+xLi$?_{充电}^{放电}$LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5_xe-=V2O5+xLi+ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
13.常温下,在100ml 12mol•L-1的浓HNO3中加入足量的铁粉,最终产生标准状况下气体的体积可能为(不考虑NO2转化为N2O4)( )
| A. | 6.72 L | B. | 8.98 L | C. | 11.56 L | D. | 13.44 L |
 和
和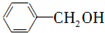 两种物质的试剂是a.
两种物质的试剂是a.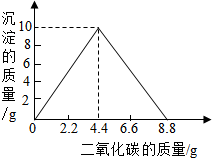 某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:
某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题: