题目内容
一定量的铜与浓硫酸在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).
(1)写出铜与浓硫酸在加热条件下反应的化学方程式; 试汁算反应后生成硫酸铜的物质的量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少? .
(1)写出铜与浓硫酸在加热条件下反应的化学方程式;
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据浓硫酸与铜在加热时发生反应生成硫酸铜、二氧化硫和水写出反应的方程式,由二氧化硫气体的体积,求出反应后生成硫酸铜的物质的量;
(2)根据硫酸铜的物质的量和稀释后溶液的体积计算出溶液中硫酸铜的物质的量浓度.
(2)根据硫酸铜的物质的量和稀释后溶液的体积计算出溶液中硫酸铜的物质的量浓度.
解答:
解:(1)根据浓硫酸与铜在加热时发生反应生成硫酸铜、二氧化硫和水,可写出反应的方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
设反应后生成硫酸铜的物质的量为n(CuSO4),由题意得:
Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑
1mol 22.4L
n(CuSO4) 2.24L
1mol:n(CuSO4)=22.4L:2.24L
解得:n(CuSO4)=0.1mol;
故答案为:Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;0.1mol;
(2)若将反应后的溶液稀释至500mL=0.5L,
该溶液中硫酸铜的物质的量浓度:
=0.2mol/L.
故答案为:0.2mol/L.
| ||
设反应后生成硫酸铜的物质的量为n(CuSO4),由题意得:
Cu+2H2SO4(浓)
| ||
1mol 22.4L
n(CuSO4) 2.24L
1mol:n(CuSO4)=22.4L:2.24L
解得:n(CuSO4)=0.1mol;
故答案为:Cu+2H2SO4(浓)
| ||
(2)若将反应后的溶液稀释至500mL=0.5L,
该溶液中硫酸铜的物质的量浓度:
| 0.1mol |
| 0.5L |
故答案为:0.2mol/L.
点评:本题考查根据方程式计算,比较基础,侧重对基础知识的巩固,注意基础知识的理解掌握.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列各环境下的离子组合一定能大量共存的是( )
| A、c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+ |
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+ |
| C、甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+ |
| D、能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42- |
下列离子方程式中正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| B、硫酸钠与氯化钡溶液混和:SO42-+Ba2+═BaSO4↓ |
| C、硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| D、氧化铜与硫酸混和:Cu2++SO42-═CuSO4 |
已知CuS、PbS、HgS的溶度积分别为l.3xl0-36、9.0x10-29、6.4x10-23.下列推断不正确的是( )
| A、向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol?L-1的溶液中通人硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS |
| B、在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜 |
| C、在含Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当c(S2-)=0.001 mol?L-1时三种金属离子都完全沉淀 |
| D、硫化钠是处理废水中含上述金属离子的沉淀剂 |
 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答. 化合物A的分子式为C3H6O2转化关系如图:
化合物A的分子式为C3H6O2转化关系如图: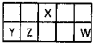 I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.