题目内容
5.某盐混合溶液中含有离子:NH4+、Mg2+、Cl-、SO42-,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(SO42-)=0.15mol•L-1.分析 该混合液呈电中性,则溶液中存在:c(NH4+)+2c( Mg2+)=c(Cl-)+2c(SO42-),带入题中数据可计算出硫酸根离子的物质的量浓度.
解答 解:溶液呈电中性,则溶液中满足:c(NH4+)+2c( Mg2+)=c(Cl-)+c(SO42-),
即:0.2mol/L+2×0.25mol/L=0.4mol/L+2c(SO42-),
解得c(SO42-)=0.15mol/L,
故答案为:0.15mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确电荷守恒的含义为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.常温下,下列溶液中,一定能大量共存的一组离子是( )
| A. | pH=1的溶液中:NH4+、K+、SO42-、ClO- | |
| B. | 含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I- | |
| C. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- | |
| D. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
4.下列实验操作中错误的是( )
| A. | 蒸馏操作时,冷凝管中冷却水应低进高出 | |
| B. | 萃取操作时,必须选择密度比水大的萃取剂 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热 |
11.下列各组物质反应后溶液或固体颜色不发生变化的是( )
| A. | 将锌粉投入CuCl2溶液 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 硝酸亚铁溶液中加入稀H2SO4 | D. | 一氧化碳通过灼热的Fe3O4粉末 |
10.图为某化学反应速率一时间图.在t1时刻升高温度或增大压强,都符合图所示变化的反应是( ) 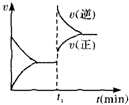

| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | B. | 2SO2(g)+O2(g)?2SO3(g)△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g)△H>0 | D. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 |
17.如图为某种甲醇燃料电池示意图,工作是电子流动方向如图所示,下列判断正确的是( )
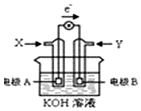

| A. | X位氧气 | |
| B. | 电极材料活泼性为:A>B | |
| C. | 电极B附近溶液碱性增强 | |
| D. | 电极A的反应式:CH3OH-6e-+H2O═CO2+6H+ |
14.下列各组离子能够在指定的环境下大量共存的是( )
| A. | 在pH=1的溶液中:Na+、K+、MnO4-、S2O32- | |
| B. | 和Al反应能产生氢气的溶液:K+、NH4+、Cl-、S2- | |
| C. | 中性溶液:Al3+、K+、SO42-、AlO2- | |
| D. | c(H+)<c(OH-)的溶液:Na+、K+、SO42-、S2- |